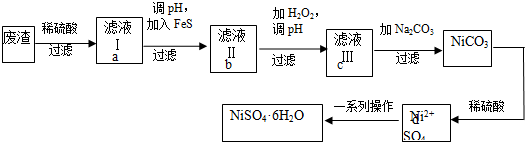
题目内容
9.下列有关物质的性质与应用不相对应的是( )| A. | Zn 具有导电性,用作锌锰干电池的负极材料 | |
| B. | 锌的金属活泼性比铁的强,可在海轮外壳上装若干锌板以减缓其腐蚀 | |
| C. | NaHCO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨忪剂 | |
| D. | 常温下浓硫酸能使铝发生钝化,常温下可用铝制容器贮藏贮运浓硫酸 |
分析 A.根据原电池的工作原理进行解答;
B.锌活泼性强于铁,形成原电池时,锌做负极失电子被氧化,铁做正极被保护;
C.二氧化碳可使糕点疏松、多孔;
D.常温下浓硫酸与铝发生钝化反应.
解答 解:A.Zn为活泼金属具有还原性,锌锰酸性干电池中,锌比锰活泼,所以锌极是负极,故A错误;
B.锌活泼性强于铁,形成原电池时,锌做负极失电子被氧化,铁做正极被保护,故B正确;
C.碳酸氢钠不稳定,加热易分解生成二氧化碳,二氧化碳可使糕点疏松、多孔,故C正确;
D.常温下浓硫酸与铝发生钝化反应,在表面生成一层致密的氧化物膜,阻碍反应的进行,可用铝制容器贮藏贮运浓硫酸,故D正确.
故选:A.
点评 本题考查了元素化合物知识,明确原电池工作原理、二氧化碳、浓硫酸的性质是解题关键,题目难度中等.

练习册系列答案
相关题目
19.氢-氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,根据原电池原理判断下列叙述正确的是( )
| A. | 负极反应:H2-2e-═2 H+ | |
| B. | 通O2的一极是发生还原反应 | |
| C. | 工作一段时间后电解质溶液的c(OH-)增大 | |
| D. | 工作时负极区附近pH增大 |
20.在生活、生产中为增大化学反应速率而采取的措施合理的是( )
| A. | 食物放在冰箱里 | B. | 在糕点包装内放置小包除氧剂 | ||
| C. | 燃煤发电时用煤粉代替煤块 | D. | 塑料制品中添加抑制剂 |
17.原子晶体干冰具有类似SiO2的晶体结构,下列有关它的推断中,错误的是( )
| A. | 它可作耐磨材料 | |
| B. | 它不可用作致冷剂 | |
| C. | 晶体中每个碳原子形成2个碳氧双键 | |
| D. | 晶体中碳、氧原子个数之比为1:2 |
4.已知NaHSO3溶液和Na2CO3溶液混合后加热煮沸能产生CO2气体.现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,则两溶液中各粒子物质的量浓度的关系一定正确的是(R表示S或C)( )
| A. | c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-) | B. | c(H+)+c(H2RO3)=c(RO32-)+c(OH-) | ||
| C. | c(Na+)>c(HRO3-)>c(H+)>c(OH-)>c(RO32-) | D. | c(HRO3-)>c(H2RO3)>c(OH-)>c(RO32-)>c(H+) |
14.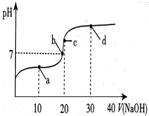 常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )
常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )
 常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )
常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
1.下列图示与对应的叙述相符的是( )
| A. | 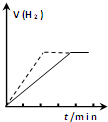 向一定质量的锌与过量的稀硫酸反应的试管中加入少量的CuSO4溶液,如图虚线表示加入CuSO4溶液时氢气体积与时间的关系 | |
| B. | 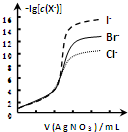 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图曲线,可确定首先沉淀的是Cl- | |
| C. | 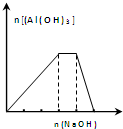 向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,图中曲线表示NaOH的物质的量与Al(OH)3物质的量关系图 | |
| D. | 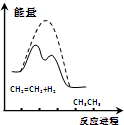 由图可说明乙烯与H2加成反应是放热反应,虚线表示在有催化剂条件下的反应进程 |