题目内容
3.下列反应生成的有机物为纯净物的是( )| A. | 甲烷和氯气光照 | B. | 氯乙烯的加聚 | ||
| C. | 溴乙烷和氢氧化钠水溶液加热 | D. | 丙烯和氯化氢加成 |
分析 A.CH4与Cl2光照可以发生一氯取代,二氯取代,三氯取代,四氯取代;
B.有机高分子中各个分子单体的数目不同,使高分子化合物成为各个不同分子数目的化合物的混合体;
C.CH3CH2Br与NaOH水溶液共热发生取代反应,-OH取代Br原子,生成CH3CH2OH;
D.丙烯和氯化氢加成,氯原子连接不饱和的碳原子有两种.
解答 解:A.产物中有一氯甲烷,二氯甲烷,三氯甲烷,四氯甲烷,没有反应掉的甲烷和氯气等,故A错误;
B.氯乙烯加聚反应产物中各个分子单体的数目不同,即聚合度不同,得到的是混合物,故B错误;
C.CH3CH2Br与NaOH水溶液共热发生取代反应,-OH取代Br原子,生成CH3CH2OH,不存在同分异构体,故C正确;
D.丙烯和氯化氢加成,可以生成1-氯丙烷和2-氯丙烷,故D错误.
故选:C.
点评 本题以纯净物概念为载体,考查取代反应、加成反应、同分异构体等,难度不大,理解有机反应类型的特点,学以致用.

练习册系列答案
相关题目
13.氢气和氯在点燃条件下反应,在反应过程中,断裂1molH2中的化学键消耗的能量为436kJ,断裂1molCl2中的化学键消耗的能量为243kJ,形成1molHCl中的化学键释放的能量为431kJ.请用此数据估计由Cl2、H2生成1mol HCl时的热效应( )
| A. | 放热91.5 kJ | B. | 放热183 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
14. 中国全运会期间,在济南市等主要街道上,出现了一座座拔地而起的立体花坛,4000万盆、上百种鲜花扮靓了济南街头.大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如右图,下列关于该分子的说法正确的是( )
中国全运会期间,在济南市等主要街道上,出现了一座座拔地而起的立体花坛,4000万盆、上百种鲜花扮靓了济南街头.大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如右图,下列关于该分子的说法正确的是( )
 中国全运会期间,在济南市等主要街道上,出现了一座座拔地而起的立体花坛,4000万盆、上百种鲜花扮靓了济南街头.大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如右图,下列关于该分子的说法正确的是( )
中国全运会期间,在济南市等主要街道上,出现了一座座拔地而起的立体花坛,4000万盆、上百种鲜花扮靓了济南街头.大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如右图,下列关于该分子的说法正确的是( )| A. | 1mol该物质与足量的NaOH溶液反应最多消耗2mol NaOH | |
| B. | 该物质在Cu作催化剂条件下能被催化氧化 | |
| C. | 该物质能发生氧化、还原、取代反应 | |
| D. | 分别与足量的Na、NaHCO3 反应生成的气体在相同状况下体积比为2:1 |
11.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.1 mol电子,锌的质量理论上减小3.25 g |
18.有硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常 温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
(5)化学小组滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:滴入一滴KMnO4溶液,溶液呈浅红色,且30秒内不褪色;实验中所需的定量仪器有托盘天平、250mL容量瓶、(酸式)滴定管(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.
(1)常 温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | 50 | 10 | t3 |
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
8.下列原子序数对应的元素间易形成共价键的是( )
| A. | 11和17 | B. | 19和9 | C. | 13和17 | D. | 20和8 |
15.元素中最高正价与负价绝对值的差等于6的是( )
| A. | N | B. | S | C. | F | D. | Cl |
12.下列物质中含有共价键的离子化合物是( )
| A. | BaCl2 | B. | AlCl3 | C. | HCl | D. | Na2O2 |
19.如图是一套电化学装置,a、b、c、d都是石墨电极,对其有关说法错误的是( )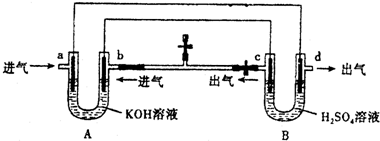

| A. | 装置A是原电池,装置B是电解池 | |
| B. | 反应一段时间后,装置B中溶液PH增大 | |
| C. | a口若消耗1molCH4,d口可产生4mol气体 | |
| D. | a口通入C2H6时的电极反应为 C2H6-14e-+18OH-═2CO32-+12H2O |