题目内容
12.下列物质中含有共价键的离子化合物是( )| A. | BaCl2 | B. | AlCl3 | C. | HCl | D. | Na2O2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,据此分析解答.
解答 解:A.氯化钡中钡离子和氯离子之间只存在离子键,为离子化合物,故A错误;
B.氯化铝中只含共价键,为共价化合物,故B错误;
C.HCl分子中H-Cl原子之间只存在共价键,为共价化合物,故C错误;
D.过氧化钠中钠离子和过氧根离子之间存在离子键,O-O原子之间存在共价键,为离子化合物,故D正确;
故选D.
点评 本题考查化学键和化合物的关系,侧重考查基本概念,明确离子键和共价键区别是解本题关键,注意不能根据是否含有金属元素判断离子键,易错选项是B.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 若完全燃烧,1 mol雄酮(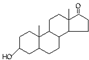 )比雌酮( )比雌酮(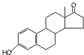 )多消耗2 mol O2 )多消耗2 mol O2 | |
| B. | 苯分子中的一个碳原子被一个氮原子代替,则新分子的式量为79 | |
| C. | 蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 | |
| D. | 只用溴水一种试剂不能鉴别甲苯、己烯、乙醇、四氯化碳四种液体 |
3.下列反应生成的有机物为纯净物的是( )
| A. | 甲烷和氯气光照 | B. | 氯乙烯的加聚 | ||
| C. | 溴乙烷和氢氧化钠水溶液加热 | D. | 丙烯和氯化氢加成 |
20.一定温度下,在固定容积的密闭容器中发生下列反应:2HI(g)?H2(g)+I2(g).若HI浓度由0.1mol•L-1降到0.07mol•L-1时,需要15s,那么HI浓度由0.07mol•L-1降到0.05mol•L-1时,所需反应的时间为( )
| A. | 等于5 s | B. | 大于10 s | C. | 等于10 s | D. | 小于10 s |
7.活泼金属的碳化物都是易水解的物质,例如:
Al4C3+12H2O→4Al(OH)3+3CH4↑
Mg2C3+4H2O→2Mg(OH)2+C3H4↑
完成下列计算:
(1)如果需要制取10.08L的乙炔(标准状况下),至少需要30g CaC2含量为96%的电石.
(2)金属碳化物Al4C3与Mg2C3组成的混合物与一定量的水反应,实验数据如下:
计算:
①混合物中Al4C3与Mg2C3的物质的量之比=1:2;
②a=22.5g;
(3)甲烷通过激光分解可制得乙炔.
主反应:2CH4→C2H2+3H2;副反应:CH4→C(s)+2H2.
在一烧瓶中加入Al4C3与CaC2组成的混合物,再向烧杯中加入足量的水,充分反应后,烧瓶质量减轻了7.4g,同时收集到气体8.96L(折算为标况).通过激光分解后,得到的气体的平均相对分子质量为11,同时有0.03g碳生成,计算甲烷的分解率.
Al4C3+12H2O→4Al(OH)3+3CH4↑
Mg2C3+4H2O→2Mg(OH)2+C3H4↑
完成下列计算:
(1)如果需要制取10.08L的乙炔(标准状况下),至少需要30g CaC2含量为96%的电石.
(2)金属碳化物Al4C3与Mg2C3组成的混合物与一定量的水反应,实验数据如下:
| 实验组号 | ① | ② | ③ | ④ |
| 碳化物(g) | 7.8 | 15.6 | 23.4 | 31.2 |
| 水(mL) | 18 | 18 | a | a |
| 气体(L/标况) | 2.8 | 5.6 | 7 | 7 |
①混合物中Al4C3与Mg2C3的物质的量之比=1:2;
②a=22.5g;
(3)甲烷通过激光分解可制得乙炔.
主反应:2CH4→C2H2+3H2;副反应:CH4→C(s)+2H2.
在一烧瓶中加入Al4C3与CaC2组成的混合物,再向烧杯中加入足量的水,充分反应后,烧瓶质量减轻了7.4g,同时收集到气体8.96L(折算为标况).通过激光分解后,得到的气体的平均相对分子质量为11,同时有0.03g碳生成,计算甲烷的分解率.
3.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如图1:
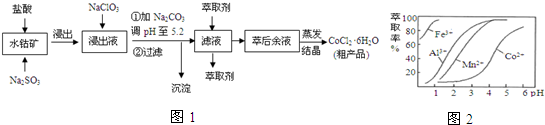
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出浸出液加入NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质 量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)写出浸出液加入NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质 量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
10.下列说法错误的是( )
| A. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| B. | 醋酸和硬脂酸互为同系物,C2H4和C18H38也互为同系物 | |
| C. | 有机物W(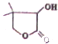 )和其水解产物都可以发生消去反应 )和其水解产物都可以发生消去反应 | |
| D. | 乙烯的加成反应及与酸性KMnO4溶液作用,都与其分子内碳碳双健有关 |
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH<7的溶液中:S${{O}_{4}}^{2-}$、C${{O}_{3}}^{2-}$、Na+、K+ | |
| B. | 使酚酞变红色的溶液中:Na+、K+、Cl-、CH3COO- | |
| C. | 0.1 mol•L-1 NH4Al(SO4)2溶液中:Al${{O}_{2}}^{-}$、Mg2+、Cl-、S${{O}_{4}}^{2-}$ | |
| D. | $\frac{{c(H}^{+})}{{c(OH}^{-})}$=1012的溶液中:Na+、Ba2+、N${{O}_{3}}^{-}$、ClO- |