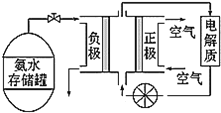
题目内容
【题目】欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一: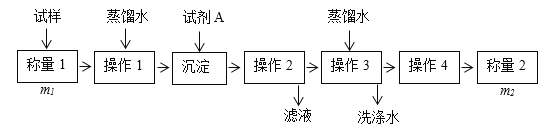
方法二: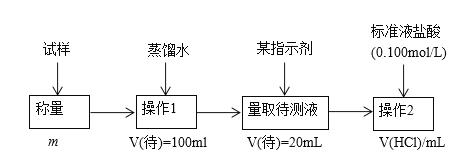
方法三: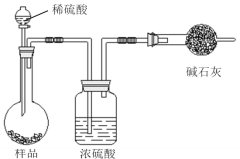
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A______(填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、_______、洗涤和_______;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒外,还需要的用到的是_____,在操作2中应选择的指示剂是____________;
(3)在方法二中计算该样品中NaHCO3的质量分数为___________[用流程图中的数据m、V(HCl) 填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是________;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是__________,偏低的原因可能是_______(均文字简述);
(6)方法四的实验原理是:_____________(用化学方程式表示)。
【答案】Ca(OH)2或Ba(OH)2 过滤 烘干 100毫升容量瓶 甲基橙 ![]() ×100% 碱石灰在实验前后的质量 碱石灰可能还会吸收空气中的水气和CO2气体 圆底烧瓶内会留存部分CO2气体 2NaHCO3
×100% 碱石灰在实验前后的质量 碱石灰可能还会吸收空气中的水气和CO2气体 圆底烧瓶内会留存部分CO2气体 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【解析】
(1)与HCO3-反应产生沉淀的试剂有Ca(OH)2 或Ba(OH)2;与HCO3-反应产生沉淀后应进行的操作为过滤、洗涤、干燥;
(2)固态样品加水溶解成100mL溶液,所以还需100mL的容量瓶;NaHCO3为弱碱性;
(3)由于盐酸与碳酸氢钠按1:1反应,所以消耗盐酸的物质的量即为碳酸氢钠的物质的量,又配100mL,取20mL进行滴定,所以原液是待测液的5倍,根据关系式可以求得NaHCO3的质量分数;
(4)根据以上方法三利用产生二氧化碳的质量来计算碳酸氢钠的质量分数,需要称量装有碱石灰的干燥管在实验前后的质量;
(5)因为碱石灰直接与空气接触,所以偏高的原因是碱石灰还会吸收空气中的二氧化碳和水使质量增大;因为装置中还会有残留的二氧化碳,所以偏低的原因是装置中会有残留的二氧化碳未被吸收;
(6)利用碳酸氢钠固体受热分解反应前后的质量差,计算碳酸氢钠的质量分数。
(1)方法一:与HCO3-反应产生沉淀的试剂有Ca Ca(OH)2 或Ba(OH)2,所以试剂A为Ca(OH)2 或Ba(OH)2;与HCO3-反应产生沉淀后应进行的操作为过滤、洗涤、烘干,故答案为:Ca(OH)2 或Ba(OH)2;过滤;烘干;
(2)方法二中固态样品加水溶解成100mL溶液,所以还需100mL的容量瓶;NaHCO3为弱碱性,指示剂用甲基橙,故答案为:100mL容量瓶;甲基橙;
(3)由于盐酸与碳酸氢钠按1:1反应,所以消耗盐酸的物质的量即为碳酸氢钠的物质的量,又配100mL,取20mL进行滴定,所以原液是待测液的5倍,所以样品中NaHCO3的质量为V(HCl)×10-3×0.100×5×84=0.042V(HCl)g,质量分数为![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%;
×100%;
(4)根据以上方法三利用产生二氧化碳的质量来计算碳酸氢钠的质量分数,需要称量装有碱石灰的干燥管在实验前后的质量,故答案为:碱石灰在实验前后的质量;
(5)因为碱石灰直接与空气接触,所以偏高的原因是碱石灰还会吸收空气中的二氧化碳和水使质量增大;因为装置中还会有残留的二氧化碳,所以偏低的原因是装置中会有残留的二氧化碳未被吸收,故答案为:碱石灰可能还会吸收空气中的水气和CO2气体;圆底烧瓶内会留存部分CO2气体;
(6)不用其他化学试剂,就只能是碳酸氢钠的受热分解,利用固体反应前后的质量差,计算碳酸氢钠的质量分数,化学方程式是2NaHCO3 ![]() Na2CO3+H2O+CO2↑,故答案为:2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:2NaHCO3 ![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。

 小学课时特训系列答案
小学课时特训系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达到平衡时,X的转化率为50%
D.增大X的浓度,Y的转化率增大