题目内容
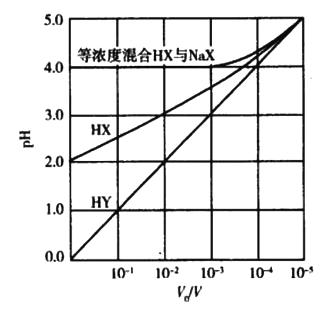
【题目】甲酸为一元弱酸,在15mL0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线。下面有关微粒浓度的大小关系正确的是
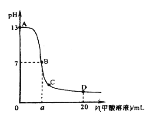
A. 在A、B间的任意一点上都存在:c(K+)>c(HCOO-)>c(OH-)>c(H+)
B. 在B点:c(K+)= c(HCOO-)>c(OH-)=c(H+),且a=7.5
C. 在C点:c(HCOO-)>c(K+)>c(H+)>c(OH-)
D. 在D点: c(HCOO-)+ c(HCOOH)=2 c(K+)
【答案】C
【解析】
A. 刚滴加甲酸时,氢氧化钾过量,c(OH-)>c(HCOO-)。
B. 滴加甲酸7.5mL时,氢氧化钾和甲酸恰好完全反应,生成物为强碱弱酸盐,,HCOO-会发生水解溶液呈碱性。
C. C点甲酸过量溶液呈酸性,c(H+)>c(OH-),根据电荷守恒可知c(HCOO-)>c(K+)。
D. D点甲酸过量,加入甲酸物质的量为0.02L×0.2mol/L=0.004mol,KOH物质的量为0.015L×0.1mol/L=0.0015mol,根据物料守恒进行分析。
A.刚滴加甲酸时,氢氧化钾过量,c(OH-)>c(HCOO-),A错误。
B.滴加甲酸7.5mL时,氢氧化钾和甲酸恰好完全反应,生成物为强碱弱酸盐,溶液呈碱性,c(OH-)>c(H+)。B点pH为7,甲酸应该稍过量,a>7.5,B错误。
C. C点甲酸过量溶液呈酸性,c(H+)>c(OH-),根据电荷守恒可知c(HCOO-)>c(K+),在C点:c(HCOO-)>c(K+)>c(H+)>c(OH-),C正确。
D. D点甲酸过量,加入甲酸物质的量为0.02L×0.2mol/L=0.004mol,KOH物质的量为0.015L×0.1mol/L=0.0015mol,根据物料守恒 c(HCOO-)+c(HCOOH)>2 c(K+),D错误。

【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示进一步转化)
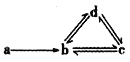
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Fe2O3 | FeCl3 | FeCl2 | Fe |
A. ①② B. ②③ C. ③④ D. ②④