题目内容
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
Ⅰ.CH4(g)![]() C(s)+2H2(g) ΔH=+75.0 kJ·mol1
C(s)+2H2(g) ΔH=+75.0 kJ·mol1
Ⅱ.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41.0 kJ·mol1
CO(g)+H2O(g) ΔH=+41.0 kJ·mol1
Ⅲ.CO(g)+H2(g)![]() C(s)+H2O(g) ΔH=131.0 kJ·mol1
C(s)+H2O(g) ΔH=131.0 kJ·mol1
①反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的ΔH=_________kJ·mol1。
2CO(g)+2H2(g)的ΔH=_________kJ·mol1。
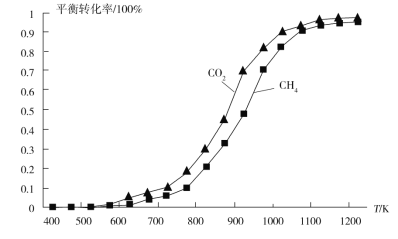
②固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率如图所示。同温度下CO2的平衡转化率大于CH4的平衡转化率,其原因是_______________。
(2)研究发现,化石燃料在O2和CO2的混合气体中燃烧与在空气中燃烧相比,烟气中NOx的排放量明显降低,其主要原因是_________________________。
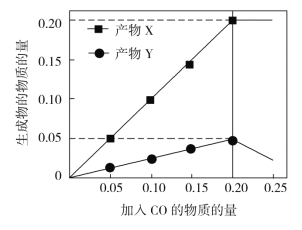
(3)为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物物质的量随CO物质的量的变化如图所示。反应的化学方程式为__________。
(4)碳酸二甲酯[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,装置如图所示,直流电源的负极为________(填“a”或“b”);阳极的电极反应式为_____________。
2(CH3O)2CO+2H2O,装置如图所示,直流电源的负极为________(填“a”或“b”);阳极的电极反应式为_____________。
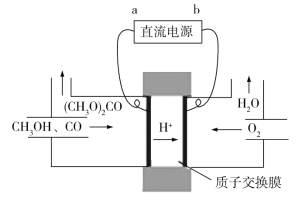
(5)用PdCl2溶液可以检验空气中少量的CO。当空气中含CO时,溶液中会产生黑色的Pd沉淀。若反应中有0.02 mol电子转移,则生成Pd沉淀的质量为_______________。
【答案】+247 CO2发生了其他副反应 CO2代替了N2,减少了N2与O2反应 4CO+2SO2![]() 4CO2+S2 b 2CH3OH+CO2e
4CO2+S2 b 2CH3OH+CO2e![]() (CH3O)2CO+2H+ 1.06 g
(CH3O)2CO+2H+ 1.06 g
【解析】
(1)分析题中重整过程中部分反应的热化学方程式,可根据盖斯定律计算目标反应的焓变值。分析图中转化率曲线,当n(CO2)=n(CH4),CO2的转化率大于CH4,分析重整过程中部分反应的热化学方程式Ⅱ,可知CO2会和H2发生副反应。
(2)相比空气,O2和CO2的混合气体中没有N2,CO2代替了N2,减少了N2与O2反应;
(3)分析题给信息,随着CO的物质的量的增大,生成物X、Y的生成量逐渐增大,但产物X的生成量大于产物Y的生成量。在CO的物质的量为0.20mol时,产物X的生成量保持不变,产物Y的生成量变小。在CO的物质的量为0.20mol时,生成产物X、Y的物质的量分别为0.20mol和0.05mol,根据质量守恒,推断X、Y的成分,进而得出反应方程式。
(4)由图可知,该装置为电解池,根据电解池原理,与电源负极相连的为阴极,发生还原反应,与电源正极相连的为阳极,发生氧化反应,根据电解池中阳离子向阴极移动,可判断出电解池的阴极。根据题给的总反应方程式,写出电极反应方程式。
(5)依据生成Pd质量,结合PdCl2~Pd~2e-,计算分析。
(1)根据盖斯定律,由①+②③得到反应CO2(g)+CH4(g)![]() 2CO( g)+2H2(g) ΔH=+247 kJ/mol;根据图示可知,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率;答案为:①+247;②CO2发生了其他副反应;
2CO( g)+2H2(g) ΔH=+247 kJ/mol;根据图示可知,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率;答案为:①+247;②CO2发生了其他副反应;
(2)CO2代替了N2,减少了N2与O2反应;答案为:CO2代替了N2,减少了N2与O2反应;
(3)根据图中信息,若以CO投入量为0.2 mol,则为0.10 mol SO2与0.20 mol CO反应生成0.05 mol Y和0.2 mol X,且“CO还原SO2”,则X与Y中有一种是CO2,根据质量守恒可知X为CO2,则Y只含有硫元素,应该为S2;故反应的化学方程式为:4CO+2SO2![]() 4CO2+S2;答案为:4CO+2SO2
4CO2+S2;答案为:4CO+2SO2![]() 4CO2+S2;
4CO2+S2;
(4)在电解池中,阳离子向阴极移动,可以得出b为直流电源的负极;阳极氧化失电子,电极反应式为2CH3OH+CO2e==(CH3O)2CO+2H+;答案为:b;2CH3OH+CO2e![]() (CH3O)2CO+2H+;
(CH3O)2CO+2H+;
(5)若空气中含CO,溶液中会产生黑色的Pd沉淀。依据PdCl2~Pd~2e,每转移2 mol电子,生成106 g Pd沉淀,共0.02 mol电子转移,则生成沉淀的质量=![]() =1.06 g。答案为:1.06 g。
=1.06 g。答案为:1.06 g。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
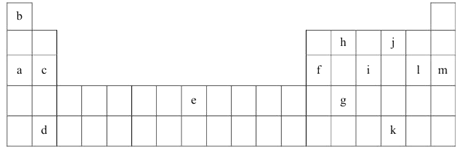
(1)上述元素的单质可能是电的良导体的是_______(填字母代号)。
(2)下表是一些气态原子的第一、二、三、四级电离能(kJ·mol-1):
锂 | X | Y | |
第一电离能 | 519 | 502 | 580 |
第二电离能 | 7296 | 4570 | 1820 |
第三电离能 | 11799 | 6920 | 2750 |
第四电离能 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:______________________________________。
②表中的Y可能为以上13种元素中的_________(填元素符号)元素,用元素符号表示X和j按原子个数1:1形成化合物的电子式___________________________。
(3)根据构造原理,用电子排布式表示e的核外电子排布式_______________。
(4)以上13种元素中,________(填元素符号)元素原子失去核外第一个电子需要的能量最多。
(5)a、e、f三种元素的最高价氧化物的水化物显碱性,其碱性最强的为_______(用化学符号作答)。f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式___________________。