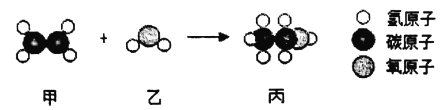
题目内容
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol M气体和3 mol N气体混合发生下列反应2M(g)+ 3N(g)![]() xQ(g)+ 3R(g),该反应达到平衡时生成2.4 mol R,并测得Q浓度为0.4 mol/L,下列叙述正确的是
xQ(g)+ 3R(g),该反应达到平衡时生成2.4 mol R,并测得Q浓度为0.4 mol/L,下列叙述正确的是
A.x值为2
B.混合气体的密度增大
C.平衡时N的浓度为 0.6 mol/L
D.N的转化率为80%
【答案】D
【解析】
试题分析:A.平衡时生成的Q的物质的量为0.4mol/L×2L=0.8mol,生成R为2.4mol,物质的量之比等于化学计量数之比,0.8mol:2.4mol=x:3,解得x=1,A项错误;B.反应体系中各组分都是气体,混合气体的质量不变,容器的容积恒定,根据ρ=m÷V可知混合气体的密度不变,B项错误;C.反应达到平衡时,生成2.4molR,由方程式可知,参加反应的N的物质的量为2.4mol,平衡时N的物质的量为3mol-2.4mol=0.6mol,N的平衡浓度为0.6mol÷2L==0.3mol/L,C项错误;D.参加反应的N的物质的量为2.4mol,则N的转化率为2.4mol÷3mol×100%=80%,D项正确;答案选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目