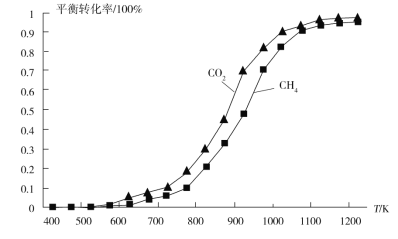
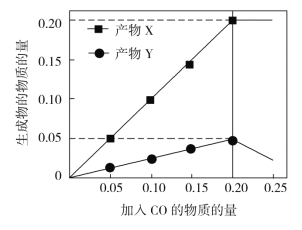
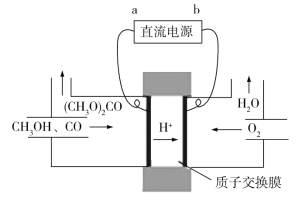
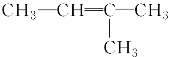题目内容
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
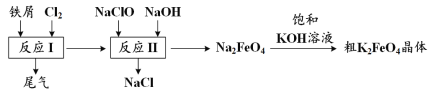
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
【答案】D
【解析】
铁与氯气反应生成氯化铁,加入NaClO、NaOH,次氯酸钠将铁离子在碱性条件下氧化成Na2FeO4,加入饱和KOH溶液可析出高铁酸钾(K2FeO4),分离得到粗K2FeO4,采用重结晶、洗涤、低温烘干将其提纯,以此解答该题。
A. K2FeO4具有强氧化性,可用于杀菌消毒,生成的铁离子可水解生成具有吸附性的氢氧化铁胶体,可用于净水,故A正确;
B. 尾气含有氯气,可与氯化亚铁反应生成氯化铁,可再利用,故B正确;
C. 反应中Cl元素化合价由+1价降低为-1价,Fe元素化合价由+3价升高到+6价,则氧化剂与还原剂的物质的量之比为3:2,故C正确;
D. 结晶过程中加入浓KOH溶液,增大了K+浓度,该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,有利于K2FeO4晶体的析出,故D错误;
故选D。

【题目】某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色 |
Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是______。
(2)实验操作Ⅱ吹入热空气的目的是_____。
(3)装置C的作用是_____,C中盛放的药品是_____。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式是_____。
(5)由上述实验得出的结论是______。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可)______。
【题目】下列实验方案设计中,无法达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 除去NaCl固体中少量的KNO3杂质 | 将固定溶于水配成溶液,蒸发结晶并趁热过滤 |
B | 检验乙酸乙酯中是否含有乙酸 | 加入含有酚酞的NaOH溶液并振荡,观察下层溶液颜色变化 |
C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
D | 比较Fe3+和I2的氧化性强弱 | 向含有淀粉的KI溶液中滴入FeCl3溶液,观察溶液颜色变化 |
A.AB.BC.CD.D