题目内容
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
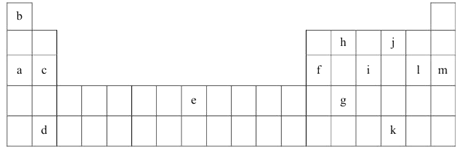
(1)上述元素的单质可能是电的良导体的是_______(填字母代号)。
(2)下表是一些气态原子的第一、二、三、四级电离能(kJ·mol-1):
锂 | X | Y | |
第一电离能 | 519 | 502 | 580 |
第二电离能 | 7296 | 4570 | 1820 |
第三电离能 | 11799 | 6920 | 2750 |
第四电离能 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:______________________________________。
②表中的Y可能为以上13种元素中的_________(填元素符号)元素,用元素符号表示X和j按原子个数1:1形成化合物的电子式___________________________。
(3)根据构造原理,用电子排布式表示e的核外电子排布式_______________。
(4)以上13种元素中,________(填元素符号)元素原子失去核外第一个电子需要的能量最多。
(5)a、e、f三种元素的最高价氧化物的水化物显碱性,其碱性最强的为_______(用化学符号作答)。f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式___________________。
【答案】(1)acdefgh (2)①Li原子失去一个电子后,Li+已形成稳定结构,此时再失去一个电子很困难
②Al;![]() (3)1s22s22p63s23p63d64s2(4)m
(3)1s22s22p63s23p63d64s2(4)m
(5)NaOH;Al2O3+2OH-=2AlO2-+H2O
【解析】
试题根据元素在周期表中的位置可知a~m元素分别为Na、H、Mg、Sr、Fe、Al、Ge、C、P、O、Te、Cl、Ar。
(1)电的良导体主要为金属、石墨等,因此元素的单质可能是电的良导体的是acdefgh。
(2)①由于Li原子失去一个电子后,Li+已形成稳定结构,此时再失去一个电子很困难,所以锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。
②元素Y失去第三个电子所需能量远远小于失去第四个电子所需的能量,故Y元素位于第ⅢA族,为Al;元素X失去第一个电子所需能量远远小于失去第二个电子所需的能量,故X元素位于第IA族,为Na;X和j按原子个数1:1形成化合物是Na2O2,电子式为![]() ;
;
(3)铁的原子序数是26,核外电子排布式为1s22s22p63s23p63d64s2。
(4)m为稀有气体元素,已达稳定结构,故很难失去电子。
(5)金属性越强,最高价氧化物水化物的碱性越强,则a、e、f三种元素的最高价氧化物的水化物中碱性最强的为NaOH。氧化铝与NaOH溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O。

【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
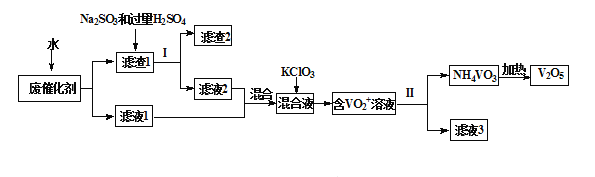
已知:a.部分含钒物质常温下在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
b.![]() +2OH-
+2OH-![]()
![]() +H2O
+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为_________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为_______________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为_____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为________________
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__________________
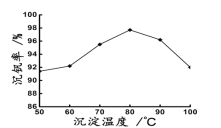
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请解释下图温度超过80℃以后,沉钒率下降的可能原因是________________________;___________________(写两条)。
(7)该工艺流程中可以循环利用的物质为__________________。
(8)测定产品中V2O5的纯度:称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182 g·mol1)的质量分数是______。(列出计算式)
【题目】化学键的键能是指气态原子间形成1 mol化学键时释放的能量。如H(g)+I(g)![]() H—I(g)放出297 kJ的能量,即H—I键的键能为297 kJ·mol-1,也可以理解为破坏1 mol H—I键需要吸收297 kJ的热量。下表是一些键能的数据(单位:kJ·mol-1)。
H—I(g)放出297 kJ的能量,即H—I键的键能为297 kJ·mol-1,也可以理解为破坏1 mol H—I键需要吸收297 kJ的热量。下表是一些键能的数据(单位:kJ·mol-1)。
共价键 | 键能 | 共价键 | 键能 | 共价键 | 键能 | 共价键 | 键能 |
H—H | 436 | Cl—Cl | 243 | H—Cl | 431 | H—O | 467 |
S | 255 | H—S | 339 | C—F | 427 | C—O | 358 |
C—Cl | 330 | C—I | 218 | H—F | 565 | N≡N | 945 |
回答下列问题:
(1)一个化学反应的反应热(设反应物、生成物均为气态)与反应物和生成物中的键能之间有密切的关系。由表中数据计算下列热化学方程式中的热效应:H2(g)+Cl2(g)![]() 2HCl(g) ΔH=____。
2HCl(g) ΔH=____。
(2)共价键的极性强弱对化学反应有很大的影响。卤代烃RX在同样条件下发生碱性水解反应(RX+NaOH![]() R—OH+NaX)时,RF、RCl、RBr、RI(R相同)的反应活性由小到大的顺序是_______。
R—OH+NaX)时,RF、RCl、RBr、RI(R相同)的反应活性由小到大的顺序是_______。
(3)根据表中数据判断CCl4的稳定性____(填“大于”或“小于”)CF4的稳定性。
(4)试预测C—Br键的键能范围(填具体数值):___<C—Br键的键能<____。