题目内容
18.将浓度为0.1mol•L-1HF溶液加水不断稀释,下列各量始终保持增大的是( )| A. | c(H+) | B. | Ka(HF) | C. | $\frac{{F}^{-}}{C({H}^{+})}$ | D. | $\frac{({F}^{-})}{C(HF)}$ |
分析 根据HF属于弱电解质,则在加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,并注意温度不变时,电离平衡常数不变来解答.
解答 解:A、因HF为弱酸,则浓度为0.1mol•L-1HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A错误;
B、因电离平衡常数只与温度有关,则Ka(HF)在稀释过程中不变,故B错误;
C、因稀释时一段时间电离产生等量的H+和F-,溶液的体积相同,则两种离子的浓度的比值不变,但随着稀释的不断进行,c(H+)不会超过10-7mol•L-1,c(F-)不断减小,则比值变小,故C错误;
D、因Ka(HF)=$\frac{c({F}^{-})•c({H}^{+})}{c(HF)}$,当HF溶液加水不断稀释,促进电离,c(F-)不断减小,Ka(HF)不变,则$\frac{c({H}^{+})}{c(HF)}$增大,故D正确;
故选D.
点评 本题考查弱电解质的稀释,明确稀释中电离程度、离子浓度、Ka的变化即可解答,本题难点和易错点是不断稀释时c(H+)不会超过10-7mol•L-1.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
8.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如图1:

已知:某些氢氧化物沉淀的pH如表所示:
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:适当升温、把硼镁泥粉碎或搅拌、或适当增加硫酸浓度.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2、CaSO4.
(4)已知MgSO4、CaSO4的溶解度如表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩,趁热过滤.“操作I”是将滤液继续蒸发浓缩,冷却结晶,过滤洗涤,便得到了MgSO4•7H2O.
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为70%.(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成图2防腐示意图,并作相应标注 和
和 .
.

已知:某些氢氧化物沉淀的pH如表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:适当升温、把硼镁泥粉碎或搅拌、或适当增加硫酸浓度.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2、CaSO4.
(4)已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为70%.(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成图2防腐示意图,并作相应标注
 和
和 .
.
9.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为14.X是元素周期表中原子半径最小的元素,Z与X原子的最外层电子数相同,Y与W同主族.下列说法正确的是( )
| A. | Y分别与X、Z形成的化合物中化学键类型相同 | |
| B. | 原子半径的大小顺序:r(Z)>r(W)>r(Y) | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | Z的最高价氧化物对应的水化物是酸 |
6.下列物质在生活中应用时,起还原作用的是( )
| A. | 食醋除水垢 | B. | 硅胶作干燥剂 | ||
| C. | 漂白粉漂白织物 | D. | 铁粉作食品袋内的脱氧剂 |
13.室温下将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s)═CuSO4(s)+5H2O(l),热效应为△H3.则下列判断正确的是( )
| A. | △H2>△H3 | B. | △H1>△H3 | C. | △H1=△H2+△H3 | D. | △H1+△H2>△H3 |
3.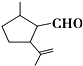 有机物A是一种重要的化工原料,其结构简式如图,下列检验A中官能团的试剂和顺序正确的是( )
有机物A是一种重要的化工原料,其结构简式如图,下列检验A中官能团的试剂和顺序正确的是( )
 有机物A是一种重要的化工原料,其结构简式如图,下列检验A中官能团的试剂和顺序正确的是( )
有机物A是一种重要的化工原料,其结构简式如图,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加KMnO4酸性溶液,再加银氨溶液,微热 | |
| B. | 先加溴水,再加KMnO4酸性溶液 | |
| C. | 先加银氨溶液,微热,再加溴水 | |
| D. | 先加入足量的新制Cu(OH)2悬浊液,微热,酸化后再加溴水 |
7.下列实验能达到实验目的是( )
| A. | 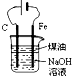 制备 Fe(OH)2 并能较 长时间观察其颜色 | |
| B. | 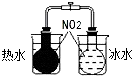 探究温度对平衡移动的影响 | |
| C. | 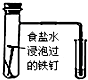 验证铁发生析氢腐蚀 | |
| D. | 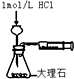 测定反应速率 |
8.下列关于浓硫酸的叙述,正确的是( )
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 浓硫酸在常温下能够使铁、铝等金属钝化 |