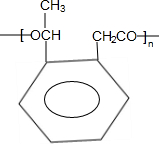
题目内容
9.下列反应中,氧化剂与还原剂的物质的量的比值从大到小的顺序排列正确的是( )①2Na2O2+2CO2═2NaCO3+O2↑
②3S+6NaOH═2Na2S+Na2SO3+3H2O
③KClO3+6HCl═KCl+3Cl2↑+3H2O.
| A. | ①②③ | B. | ②①③ | C. | ①③② | D. | ②③① |
分析 ①2Na2O2+2CO2═2NaCO3+O2↑反应中Na2O2既是氧化剂又是还原剂,反应中氧化剂与还原剂物质的量相同;
②3S+6NaOH═2Na2S+Na2SO3+3H2O反应中2molS被还原,1molS被氧化;
③KClO3+6HCl═KCl+3Cl2↑+3H2O反应中KClO3是氧化剂,HCl是还原剂,结合反应中元素的化合价变化分析.
解答 解:①2Na2O2+2CO2═2NaCO3+O2↑反应中Na2O2既是氧化剂又是还原剂,反应中氧化剂与还原剂物质的量相同,即氧化剂与还原剂的物质的量的比为1:1;
②3S+6NaOH═2Na2S+Na2SO3+3H2O反应中2molS被还原,1molS被氧化,则氧化剂与还原剂的物质的量的比为2:1;
③KClO3+6HCl═KCl+3Cl2↑+3H2O反应中KClO3是氧化剂,HCl是还原剂,其中6molHCl中有5molHCl被氧化作还原剂,则氧化剂与还原剂的物质的量的比为1:5;
所以氧化剂与还原剂的物质的量的比值从大到小的顺序排列为:②①③;
故选B.
点评 本题考查了氧化还原反应,侧重于考查氧化剂和还原剂的判断,注意③反应中部分HCl作还原剂,部分只起酸的作用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列说法正确的是 ( )
| A. | 饮用水就是纯水,是纯净物 | |
| B. | 有机食品,就是有机合成的食品 | |
| C. | 将化工厂的烟囱建高,不能缓解大气污染 | |
| D. | 燃煤时,鼓入过量的空气可以减少酸雨的产生 |
17.下列除杂(括号内的为杂质)试剂、方法和相关反应不正确的是( )
| A. | FeCl2(FeCl3)--加入足量铁粉,然后过滤,Fe+2FeCl3═3FeCl2 | |
| B. | NaCl(NaI)--加入适量氯水,用CCl4萃取分液,Cl2+2NaI═2NaCl+I2 | |
| C. | SiO2(Al2O3)--加入足量NaOH溶液,然后过滤,Al2O3+2NaOH═2NaAlO2+H2O | |
| D. | CaCl2(NH4Cl) 固体混合物--直接加热NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
4. 甲醇是重要的化工原料,又可作为燃料.
甲醇是重要的化工原料,又可作为燃料.
工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
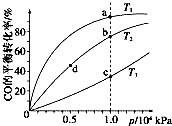
(4)反应①按照相同的物质的量投料,测得CO在不
同温度下的平衡转化率与压强的关系如右图所示.
下列说法正确的是 (填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
 甲醇是重要的化工原料,又可作为燃料.
甲醇是重要的化工原料,又可作为燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不
同温度下的平衡转化率与压强的关系如右图所示.
下列说法正确的是 (填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
14.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
| A. | CH2=CH2+Br2(CCl4)→ | B. | CH2=CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | ||
| C. | C(CH3)4+Cl2$\stackrel{光照}{→}$ | D. | n CH3-CH=CH2$→_{△}^{催化剂}$ |
1.已知H2S能被下列物质氧化,各物质发生下列变化:Fe3+→Fe2+;Cr2O${\;}_{7}^{2-}$→2Cr3+;Br2→2Br-;HNO3→NO.如果氧化等物质的量的H2S气体得到S单质,需要上述离子或物质的物质的量最小的是( )
| A. | Fe3+ | B. | Cr2O${\;}_{7}^{2-}$ | C. | Br2 | D. | HNO3 |
18.2gAO32-的核外电子数比质子数多3.01×1022个,则A的相对原子质量为( )
| A. | 12 | B. | 32 | C. | 60 | D. | 80 |
8.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如图1:

已知:某些氢氧化物沉淀的pH如表所示:
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:适当升温、把硼镁泥粉碎或搅拌、或适当增加硫酸浓度.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2、CaSO4.
(4)已知MgSO4、CaSO4的溶解度如表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩,趁热过滤.“操作I”是将滤液继续蒸发浓缩,冷却结晶,过滤洗涤,便得到了MgSO4•7H2O.
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为70%.(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成图2防腐示意图,并作相应标注 和
和 .
.

已知:某些氢氧化物沉淀的pH如表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:适当升温、把硼镁泥粉碎或搅拌、或适当增加硫酸浓度.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2、CaSO4.
(4)已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为70%.(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成图2防腐示意图,并作相应标注
 和
和 .
. 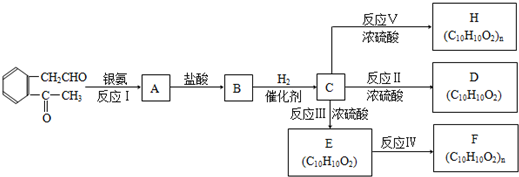
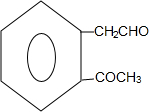 +2Ag(NH3)2OH→
+2Ag(NH3)2OH→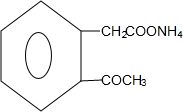 +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O;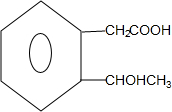 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$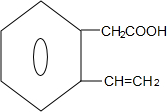 +H2O
+H2O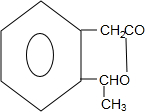 F
F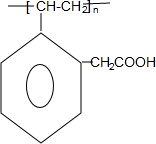 H
H