题目内容
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g) ![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③2CO(g) ![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:____
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
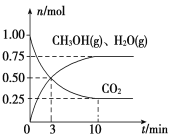
①从反应开始到平衡,氢气的平均反应速率v(H2)=________。
②下列措施一定不能使CO2的平衡转化率增大的是________。
A 在原容器中再充入1 mol CO2
B 在原容器中再充入1 mol H2
C 在原容器中充入1 mol氦气
D 使用更有效的催化剂
E 缩小容器的容积
F 将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
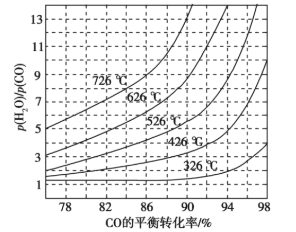
①上述反应的正反应方向是________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=_____(填表达式,不必代数计算);如果提高p(H2O)/p(CO),则Kp_______(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、p(H2O)/p(CO)=3~5,采用此条件的原因可能是_______
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述错误的是________。
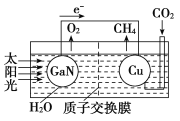
A.该装置能量转化形式仅存在将太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+===CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
【答案】CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH=-162 kJ·mol-1 0.112 5 mol·L-1·min-1 ACD 放热 pCO2pH2/pCOpH2O 不变 催化剂的活性温度在400 ℃左右;投料比太低,CO的平衡转化率不高,而400 ℃左右,投料比3~5时CO的平衡转化率较高,已能满足要求,再增加投料比,成本增大,但CO的平衡转化率提高不多,经济上不合算 A
CH4(g)+2H2O(g) ΔH=-162 kJ·mol-1 0.112 5 mol·L-1·min-1 ACD 放热 pCO2pH2/pCOpH2O 不变 催化剂的活性温度在400 ℃左右;投料比太低,CO的平衡转化率不高,而400 ℃左右,投料比3~5时CO的平衡转化率较高,已能满足要求,再增加投料比,成本增大,但CO的平衡转化率提高不多,经济上不合算 A
【解析】
(1)依据热化学方程式和盖斯定律分析计算;
(2)①根据图知,达到平衡状态时n(CH3OH)=n(H2O)=0.75mol,根据H原子守恒得消耗n(H2)=2n(CH3OH)+n(H2O)=2×0.75mol+0.75mol=2.25mol,结合v(H2)=![]() 计算;
计算;
②使CO2的转化率增大须使平衡向正反应方向移动,可采取的措施有增大压强、分离生成物或增加另一种反应物等措施;
(3)①由图可知,在相同的 时,温度越高,CO的转化率越低,据此分析判断;②根据平衡常数的含义结合平衡常数只与温度有关判断;结合投料比、催化剂的活性、经济成本分析解答;
时,温度越高,CO的转化率越低,据此分析判断;②根据平衡常数的含义结合平衡常数只与温度有关判断;结合投料比、催化剂的活性、经济成本分析解答;
(4)该装置中,根据电子流向可知GaN是负极、Cu是正极,负极反应式为:2H2O-4e-=4H++O2↑,正极反应式为:CO2+8e-+8H+=CH4+2H2O,据此分析解答。
(1)①CO(g)+H2O(g)H2(g)+CO2(g)△H=-41kJmol-1,②C(s)+2H2(g)CH4(g)△H=-73kJmol-1,③2CO(g)C(s)+CO2(g)△H=-171kJmol-1,盖斯定律计算②+③-①×2 得到CO2(g)+4H2(g)═CH4(g)+2H2O(g)△H=-162 kJmol-1,故答案为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH=-162 kJmol-1;
CH4(g)+2H2O(g) ΔH=-162 kJmol-1;
(2)①根据图知,达到平衡状态时n(CH3OH)=n(H2O)=0.75mol,根据H原子守恒得消耗n(H2)=2n(CH3OH)+n(H2O)=2×0.75mol+0.75mol=2.25mol,从反应开始到平衡,氢气的平均反应速率v(H2)=![]() =
= =0.1125mol/(Lmin),故答案为:0.1125mol/(Lmin);
=0.1125mol/(Lmin),故答案为:0.1125mol/(Lmin);
②A.在原容器中再充入l mol CO2,平衡正向移动,但是反应消耗的二氧化碳增加量小于加入二氧化碳增加量,所以二氧化碳的转化率减小,故A选;B.在原容器中再充入1mol H2,平衡正向移动,消耗的二氧化碳量增加,则二氧化碳转化率增大,故B不选;C.在原容器中充入l mol氦气,参加反应的各物质的物质的量浓度不变,平衡不移动,则二氧化碳转化率不变,故C选;D.使用更有效的催化剂,增大化学反应速率,但是平衡不移动,则二氧化碳转化率不变,故D选;E.缩小容器的容积,增大压强平衡向气体体积减小的正反应方向移动,二氧化碳转化率增大,故E不选;F.将水蒸气从体系中分离,平衡正向移动,二氧化碳转化率增大,故F不选;不能使CO2的平衡转化率增大的有ACD,故答案为:ACD;
(3)①由图可知,在相同的 时,温度越高,CO的转化率越低,说明升高温度,平衡逆向移动,说明正反应为放热反应,故答案为:放热;
时,温度越高,CO的转化率越低,说明升高温度,平衡逆向移动,说明正反应为放热反应,故答案为:放热;
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=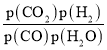 ;平衡常数只与温度有关,与浓度无关,所以提高
;平衡常数只与温度有关,与浓度无关,所以提高 比,则KP不变;由图象可知,投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高,再增加投料比,需要大大的增加蒸汽添加量,这样在经济上不合算,温度在400℃左右时催化剂的活性最大,所以一般采用400℃左右,
比,则KP不变;由图象可知,投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高,再增加投料比,需要大大的增加蒸汽添加量,这样在经济上不合算,温度在400℃左右时催化剂的活性最大,所以一般采用400℃左右, =3~5,故答案为:
=3~5,故答案为: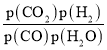 ;不变;催化剂的活性温度在400 ℃左右;投料比太低,CO的平衡转化率不高,而400 ℃左右,投料比3~5时CO的平衡转化率较高,已能满足要求,再增加投料比,成本增大,但CO的平衡转化率提高不多,经济上不合算;
;不变;催化剂的活性温度在400 ℃左右;投料比太低,CO的平衡转化率不高,而400 ℃左右,投料比3~5时CO的平衡转化率较高,已能满足要求,再增加投料比,成本增大,但CO的平衡转化率提高不多,经济上不合算;
(4) A.根据图示可知,该装置中将太阳能转化为电能和化学能,故A错误;B.根据电子流向可知,Cu是正极,正极上二氧化碳得电子和氢离子反应生成甲烷,电极反应式为:CO2+8e-+8H+=CH4+2H2O,故B正确;C.放电时,电解质溶液中阳离子向正极移动,所以装置中的H+由左向右移动,故C正确;故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案