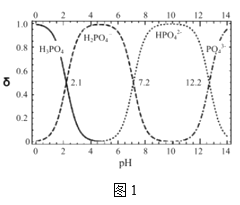
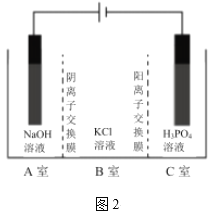
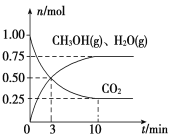
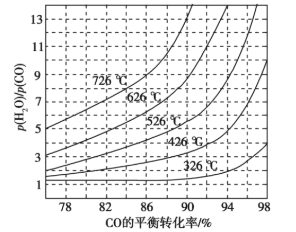
题目内容
【题目】下列指定反应的离子方程式正确的是
A.H2SO4酸化的KI溶液中加入H2O2:2I-+H2O2+2H+=I2+2H2O
B.SO2通入BaCl2溶液中:SO2+Ba2++H2O=BaSO3↓+2H+
C.(NH4)2Fe(SO4)2溶液中加入少量NaOH溶液:NH4++OH-=NH3·H2O
D.用CuCl2溶液做导电性实验,灯泡发光:CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
【答案】A
【解析】
A. H2SO4酸化的KI溶液中加入H2O2生成碘和水:2I-+H2O2+2H+=I2+2H2O,故A正确;
B.盐酸的酸性强于亚硫酸, SO2通入BaCl2溶液不反应,故B错误;
C. Fe(OH)2比NH3·H2O更难电离,(NH4)2Fe(SO4)2溶液中加入少量NaOH溶液:先发生Fe2++2OH-=Fe(OH)2↓,故C错误;
D. 用CuCl2溶液做导电性实验,灯泡发光:CuCl2![]() Cu+Cl2↑,故D错误;
Cu+Cl2↑,故D错误;
故选A。

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
【题目】一定温度下,在3个容积均为1.0L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。下列说法正确的是
PCl3(g)+Cl2(g)。下列说法正确的是
容器 编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(PCl5) | c(PCl3) | c(Cl2) | c(Cl2) | |
Ⅰ | 0.4 | 0 | 0 | 0.2 |
Ⅱ | 1.05 | 0.05 | 1.95 | |
Ⅲ | 0.8 | 0 | 0 | |
A.达平衡时,容器Ⅰ中![]() 比容器Ⅱ中的大
比容器Ⅱ中的大
B.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为6∶31
C.达平衡时,容器Ⅲ中Cl2的体积分数大于![]()
D.达平衡时,容器Ⅲ中0.4mol·L-1<c(PCl5)<0.8mol·L-1