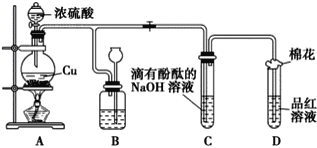
题目内容
【题目】I. 今有12种物质:①A1 ②稀硝酸 ③H2SO4 ④液氨 ⑤CO2 ⑥空气 ⑦NaCl CaCO3 NaHCO3 酒精![]() Al2O3
Al2O3 ![]() 石墨。以上物质中属于电解质但熔融状态下并不导电的是____________(填序号,下同),属于非电解质的是___________。
石墨。以上物质中属于电解质但熔融状态下并不导电的是____________(填序号,下同),属于非电解质的是___________。
II.按要求填写化学用语:
(1)Na2SO4的电离方程式:_______________________;
(2)Ba(OH)2与CuSO4两稀溶液混合的离子方程式:______________________;
(3)写一个能用Fe3++30H-═Fe(OH)3表示的化学方程式:______________________。
【答案】②③ ①④⑤⑩ Na2SO4 = 2Na+ + SO42- Ba2++2OH-+Cu2++SO42+=BaSO4+Cu(OH)2 FeCl3+3KOH=Fe(OH)3+3KCl
【解析】
I. ①A1是金属单质,可以导电,既不是电解质也不是非电解质;
②稀硝酸中存在自由移动的氢离子和硝酸根离子,可以导电,但属于混合物,既不是电解质也不是非电解质;
③H2SO4在水溶液中能导电的化合物,电解质自身电离出自由移动的离子,属于电解质;
④液氨在水溶液中生成一水合氨是能电离从而溶液导电的化合物,氨自身不能电离出自由移动的离子,属于非电解质;
⑤CO2在水溶液中生成碳酸是能电离从而溶液导电的化合物,二氧化碳自身不能电离出自由移动的离子,属于非电解质;
⑥空气不导电,属于混合物,既不是电解质也不是非电解质;
⑦NaCl晶体是电解质,不能导电;
CaCO3 晶体是电解质,不能导电;
NaHCO3 晶体是电解质,不能导电;
酒精 为非电解质,不导电;
![]() 熔化的Al2O3为电解质,能导电;
熔化的Al2O3为电解质,能导电;
![]() 石墨是非金属单质,可以导电,既不是电解质也不是非电解质;
石墨是非金属单质,可以导电,既不是电解质也不是非电解质;
属于电解质但熔融状态下并不导电的是②③ (填序号,下同),属于非电解质的是①④⑤⑩;
II.按要求填写化学用语:
(1)Na2SO4属于强电解质,在水中全部电离,Na2SO4的电离方程式: Na2SO4 = 2Na+ + SO42- ;
(2)Ba(OH)2与CuSO4两稀溶液混合生成氢氧化铜和硫酸钡沉淀,离子方程式:Ba2++2OH-+Cu2++SO42+=BaSO4+Cu(OH)2 ;
(3)能用Fe3++3OH-═Fe(OH)3表示的化学方程式,应是可溶性铁盐和可溶性强碱反应生成氢氧化铁沉淀和另一种可溶性盐,如:FeCl3+3KOH=Fe(OH)3+3KCl。

【题目】富马酸亚铁,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与![]() ,反应得富马酸亚铁。
,反应得富马酸亚铁。
已知:
物质名称 | 化学式 | 相对分子质量 | 电离常数(25℃) |
富马酸 |
| 116 |
|
碳酸 |
|
| |
富马酸亚铁 | FeC4H2O4 | 170 |
i.制备富马酸亚铁:
①将富马酸置于100mL烧杯A中,加热水搅拌
②加入![]() 溶液10mL使溶液pH为6.5-6.7。并将上述溶液移至100mL容器B中
溶液10mL使溶液pH为6.5-6.7。并将上述溶液移至100mL容器B中
③安装好回流装置C,加热至沸。然后通过恒压滴液漏斗D缓慢加入![]() 溶液30mL
溶液30mL
④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量
请回答以下问题:
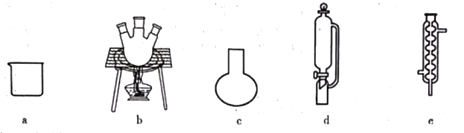
(1)该实验涉及到的主要仪器需从以上各项选择,则B为__________(填字母),C为___________(填名称)。
(2)已知反应容器中反应物![]() 和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入
和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入溶液调节pH的目的是______________________________________________;若加入
![]() 溶液过量,溶液pH偏高,则制得产品的纯度会_____________(填“偏高”“偏低”或“无影响”)。
溶液过量,溶液pH偏高,则制得产品的纯度会_____________(填“偏高”“偏低”或“无影响”)。
(3)配制![]() 溶液方法为称取
溶液方法为称取![]() 固体,溶于30mL新煮沸过的冷水中,需用新煮沸过的冷水的原因是____________________________________________________________________________。
固体,溶于30mL新煮沸过的冷水中,需用新煮沸过的冷水的原因是____________________________________________________________________________。
(4)步骤④中洗涤的目的主要是为了除去是___________离子,检验沉淀是否洗净的方法是:_____________。
ii.计算产品的产率:
(5)经测定,产品中富马酸亚铁的纯度为76.5%。以5.80g富马酸为原料反应制得产品8.10g,则富马酸亚铁的产率为_____________%。(保留小数点后一位)