题目内容
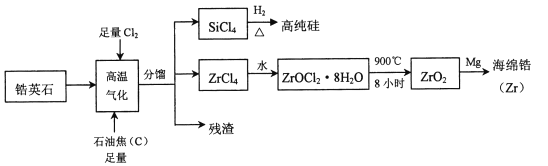
【题目】锆(![]() )是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是
)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是![]() ,还含有少量
,还含有少量![]() 等杂质)为原料生产锆及其化合物的流程如图所示
等杂质)为原料生产锆及其化合物的流程如图所示
(1)写出![]() 的电子式____________________。
的电子式____________________。
(2)高温气化过程中,不考虑损失,发现分馏后得到的![]() 质量通常比由纯
质量通常比由纯![]() 发生的反应得到的
发生的反应得到的![]() 质量大,用化学方程式来解释原因_________________________。
质量大,用化学方程式来解释原因_________________________。
(3)高温气化后的固体残渣除碳外,还有![]() 和
和![]() ,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和
,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和![]() 两种固体的方法是____________________。
两种固体的方法是____________________。
(4)写出上述流程中![]() 与水反应的化学方程式:____________________________。
与水反应的化学方程式:____________________________。
(5)已知氧化锆(![]() )是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
)是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
(6)工业上可用钾还原![]() 时制得金属
时制得金属![]() ,
,![]() 被还原时生成的钾盐的物质的量为_________________。
被还原时生成的钾盐的物质的量为_________________。
(7)已知![]() ,
,![]() 。下列说法正确的是__________
。下列说法正确的是__________
A.![]() ,电解质溶液的
,电解质溶液的![]() 与
与![]() 之和均为14
之和均为14
B.用盐酸滴定某浓度的![]() 溶液,滴定过程中
溶液,滴定过程中![]() 逐渐增大
逐渐增大
C.![]() 溶液中逐滴加入硫酸溶液,滴加过程中
溶液中逐滴加入硫酸溶液,滴加过程中![]() 逐渐减小
逐渐减小
D.某温度下![]() ,则其溶液中
,则其溶液中![]()
【答案】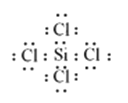
![]() 加入
加入![]() 溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得
溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得![]() (或先用盐酸浸取,再用氨水也可)
(或先用盐酸浸取,再用氨水也可) ![]()
![]()
![]()
![]()
【解析】
锆英石(主要成分为ZrSiO4,也可表示为ZrO2SiO2,还含少量Al2O3、SiO2、Fe2O3等杂质),通入足量的氯气以及和足量的石焦油反应,ZrSiO4转化为ZrCl4,加水水解,使ZrCl4转化为ZrOCl28H2O,900℃加热分解,即可得到ZrO2,加入镁置换得到海绵锆,据此分析作答。
(1)SiCl4分子中硅原子最外层有4个电子,能形成4个共价键达到稳定结构,每个氯原子能形成一个共价键达到稳定结构,电子式为: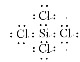 ,
,
故答案为: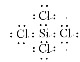 ;
;
(2)高温气化过程中,二氧化硅和氯气与碳反应生成氯化硅与一氧化碳,其化学方程式为:![]() ,
,
故答案为:![]() ;
;
(3)分离出碳和![]() ,从
,从![]() 的两性来分析,如先加入
的两性来分析,如先加入![]() 溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得
溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得![]() ;或先用盐酸浸取过滤得碳,再向滤液加入过量氨水得到沉淀,最后再加热得到
;或先用盐酸浸取过滤得碳,再向滤液加入过量氨水得到沉淀,最后再加热得到![]() ,
,
故答案为:加入![]() 溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得
溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得![]() (或先用盐酸浸取,再用氨水也可);
(或先用盐酸浸取,再用氨水也可);
(4)根据流程图可知ZrCl4与水反应产物为ZrOCl28H2O,根据原子守恒,反应方程式为:ZrCl4+9H2O═ZrOCl28H2O+2HCl,
故答案为:ZrCl4+9H2O═ZrOCl28H2O+2HCl;
(5)结合氧化铝的两性,根据已知条件可知,氧化锆(![]() )与氢氧化钠共熔融可形成酸盐的化学方程式为:
)与氢氧化钠共熔融可形成酸盐的化学方程式为:![]() ,
,
故答案为:;
(6)用钾还原![]() 时制得金属
时制得金属![]() ,根据氧化还原反应的规律得出其化学方程式为:K2ZrF6+4K=Zr+6KF,根据关系式得出若
,根据氧化还原反应的规律得出其化学方程式为:K2ZrF6+4K=Zr+6KF,根据关系式得出若![]() 被还原时生成的钾盐(KF)的物质的量为6mol,
被还原时生成的钾盐(KF)的物质的量为6mol,
故答案为:6mol;
(7) A.![]() ,根据水的离子积可知,
,根据水的离子积可知,![]() ×
×![]() =10-14,结合公式
=10-14,结合公式![]() 可推出,电解质溶液的
可推出,电解质溶液的![]() 与
与![]() 之和均为14,A项正确;
之和均为14,A项正确;
B. 用盐酸滴定某浓度的![]() 溶液,滴定过程中
溶液,滴定过程中![]() 逐渐减小,则
逐渐减小,则![]() ,B项正确;
,B项正确;
C.![]() 溶液中逐滴加入硫酸溶液,生成硫酸钡,滴加过程中
溶液中逐滴加入硫酸溶液,生成硫酸钡,滴加过程中![]() 逐渐减小,
逐渐减小,![]() 会逐渐增大,C项错误;
会逐渐增大,C项错误;
D. ![]() ,则溶液中c(Zr4+)·c2(CO32-)=4.0×10-12,则-lg c(Zr4+)·c2(CO32-)=12-2lg2,即pc(Zr4+)+2p c(CO32-)=11.4,D项错误;
,则溶液中c(Zr4+)·c2(CO32-)=4.0×10-12,则-lg c(Zr4+)·c2(CO32-)=12-2lg2,即pc(Zr4+)+2p c(CO32-)=11.4,D项错误;
答案选AB。

 寒假学与练系列答案
寒假学与练系列答案