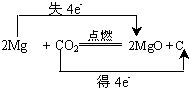
题目内容
15.用铂电极电解下列电解质溶液(足量)时,当消耗相同电量时,在阳极上有气泡冒出且溶液的pH升高的是( )| A. | KCl | B. | CuSO4 | C. | AgNO3 | D. | H2SO4 |
分析 依据电解原理和溶液中离子放电顺序分析判断电极反应,依据电解生成的产物分析溶液pH变化.
解答 解:A.用铂电极电解氯化钾溶液,生成氢氧化钾和氢气、氯气,反应生成碱,溶液pH值升高,故A正确;
B.用铂电极电解硫酸铜溶液,生成铜、氧气和硫酸,反应生成酸,溶液pH降低,故B错误;
C.用铂电极电解硝酸银溶液,生成银、氧气和硝酸,反应生成酸,溶液pH降低,故C错误;
D.用铂电极电解硫酸,相当于电解水,硫酸浓度增大,溶液pH降低,故D错误;
故选:A.
点评 本题考查了电解原理的分析应用,明确电解池工作原理,准确判断阳极、阴极放电离子是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.如图,有关铁钉腐蚀(除②外,电解质溶液为食盐水)说法不正确的是( )
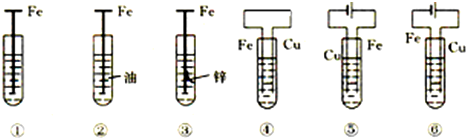

| A. | ③是牺牲阳极的阴极保护法 | |
| B. | 若将⑥的Cu极换成不溶性电极,则⑥是外加电流的阴极保护法 | |
| C. | 腐蚀快到慢的顺序为⑤>④>①>⑥>③>② | |
| D. | ①发生析氢腐蚀 |
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.56 L甲烷中含有的共价键数为0.1NA | |
| B. | 标准状况下,1mol SO3含有的氧原子数为3NA | |
| C. | 3mol NO2和足量H2O反应,转移1 NA个电子 | |
| D. | pH=1的稀硫酸中含有的H+数为0.1NA |
3.在下列各溶液中,离子一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 含Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | pH=13的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 强碱性溶液中:K+、Al3+、Cl-、SO42- |
10.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )
| A. | 四种元素的原子半径:A<B<D<C | |
| B. | D元素处于元素周期表中第3周期第ⅥA族 | |
| C. | B、D的最高价氧化物中,B、D与氧原子之间均为双键 | |
| D. | 一定条件下,D单质能置换出B单质,C单质能置换出A单质 |
20.用NA表示阿佛加德罗常数,下列叙述正确的是( )
| A. | 56g铁被氧化时,失去电子数目一定是2NA | |
| B. | 常温常压下,71g Cl2中含电子总数为34NA | |
| C. | 标准状况下,2.24L SO3中,含分子总数为0.1NA | |
| D. | CnH2n+2分子中含有共价键数为(3n+1)NA |
7.用胶头滴管向用石蜡围成的“spark”凹槽内注入某溶液,即可在玻璃上刻蚀出“spark”的字样,则该溶液是( )
| A. | 盐酸 | B. | 氢氟酸 | C. | 烧碱 | D. | 饱和食盐水 |

 ;
;