题目内容
10.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )| A. | 四种元素的原子半径:A<B<D<C | |
| B. | D元素处于元素周期表中第3周期第ⅥA族 | |
| C. | B、D的最高价氧化物中,B、D与氧原子之间均为双键 | |
| D. | 一定条件下,D单质能置换出B单质,C单质能置换出A单质 |
分析 A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,若B为第二周期元素,则2x=2,x=1,则A为H,B与D同主族,原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,B为C,C为Na,D为Si,它们的核电荷数1+6+11+14=32,符合题意;若B为第三周元素,则2x=8,x=4,A为碳,C为硅,B和D没有符合题意的元素,
A.电子层数越多,半径越大,在同一周期从左到右原子半径在减小;
B.D为硅,利用电子排布来分析其位置;
C.二氧化碳中是碳氧双键,而二氧化硅中是硅氧单键;
D.高温下,碳与二氧化硅能发生反应,常温下钠与水反应.
解答 解:A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,若B为第二周期元素,则2x=2,x=1,则A为H,B与D同主族,原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,B为C,C为Na,D为Si,它们的核电荷数1+6+11+14=32,符合题意;若B为第三周元素,则2x=8,x=4,A为碳,C为硅,B和D没有符合题意的元素,
A.电子层数越多,半径越大,在同一周期从左到右原子半径在减小,则半径关系为C>D>B>A,故A正确;
B.D为硅,Si原子核外有3个电子层、最外层电子数是4,所以位于第三周期第IVA族,故B错误;
C.二氧化碳中是碳氧双键,而二氧化硅中是硅氧单键,故C错误;
D.高温下,碳与二氧化硅能发生反应,常温下钠与水反应,所以B单质能置换出D单质,C单质能置换出A单质,故D错误;
故选A.
点评 本题考查原子结构和元素周期律、元素性质关系,正确推断元素是解本题关键,结合物质结构、元素周期律、物质性质解答即可,易错选项是C.

| A. | 质量数为13 | B. | 中子数为6 | C. | 质子数为6 | D. | 最外层电子数为6 |
| A. | 废旧塑料--回收再利用 | B. | 医疗垃圾--焚烧 | ||
| C. | 厨余垃圾--堆肥 | D. | 废旧电池--填埋 |
| A. | 504 mL | B. | 168 mL | C. | 224 mL | D. | 336 ml |
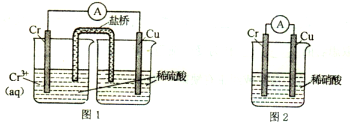
| A. | KCl | B. | CuSO4 | C. | AgNO3 | D. | H2SO4 |
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 大理石与醋酸:CaCO3+2H+=Ca2++H2O+CO2 | |
| C. | 碳酸氢钙溶液中加入石灰水:Ca2++2HCO3-+2OH-=CaCO3+CO32-+2H2O | |
| D. | 明矾溶于水:Al3++3H2O?Al(OH)3+3H+ |
| A. | 2:1 | B. | 3:2 | C. | 3:4 | D. | 5:4 |