题目内容
3.在下列各溶液中,离子一定能大量共存的是( )| A. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 含Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | pH=13的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 强碱性溶液中:K+、Al3+、Cl-、SO42- |
分析 离子之间不反应生成气体、沉淀、弱电解质或发生氧化还原反应、双水解反应、络合反应的就能共存,
A.pH=1的溶液呈酸性,硝酸根离子具有强氧化性;
B.和铁离子反应的离子不能大量共存;
C.pH=13的溶液呈碱性,离子之间不反应且和氢氧根离子不反应的能大量共存;
D.强碱性条件下,离子之间不反应且和氢氧根离子不反应的能大量共存.
解答 解:A.pH=1的溶液呈酸性,Fe2+、NO3-发生氧化还原反应而不能大量共存,故A错误;
B.Fe3+、S2-发生氧化还原反应而不能大量共存,故B错误;
C.pH=13的溶液呈碱性,离子之间不反应且和氢氧根离子不反应的能大量共存,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故C正确;
D.强碱性条件下,Al3+和氢氧根离子反应而不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高频考点,侧重考查氧化还原反应、复分解反应,明确离子共存条件及离子性质即可解答,易错选项是B.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
13.在氧化还原反应中,水被还原的是( )
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | Cl2+H2O═HCl+HClO | D. | 3NO2+H2O═2HNO3+NO |
14.与普通玻璃主要成分不相同的是( )
| A. | 钢化玻璃 | B. | 玻璃纸 | C. | 有机玻璃 | D. | 水玻璃 |
11.下列实验操作正确的是( )
| A. | 固体碘与NH4Cl的混合物可以用加热升华的方法分离 | |
| B. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| C. | 可以用米汤检验含碘食盐中的碘元素 | |
| D. | 水银洒落时,可在其表面覆盖一层硫粉进行处理 |
8.在容积不变的密闭容器中,在一定条件下发生反应:2A?B(g)+C(g),且达到平衡.当升高温度时气体的密度增大,则( )
| A. | 若正反应是吸热反应,则A为非气态 | B. | 若正反应是吸热反应,则A为气态 | ||
| C. | 若正反应是放热反应,则A为气态 | D. | 若正反应是放热反应,则A为非气态 |
15.用铂电极电解下列电解质溶液(足量)时,当消耗相同电量时,在阳极上有气泡冒出且溶液的pH升高的是( )
| A. | KCl | B. | CuSO4 | C. | AgNO3 | D. | H2SO4 |
1.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义.分析下面两种处理方案,回答下列问题:
Ⅰ、利用废液再生刻蚀液
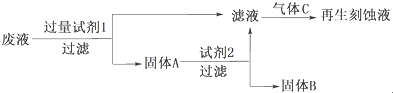
(1)试剂2是HCl,固体B是Cu,通入的气体C是Cl2.(填化学式)
(2)写出加入试剂1发生反应的离子方程式:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu.
Ⅱ、利用废液制备CuCl2•2H2O晶体
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
实验方案:

(1)为确保产品的纯度,试剂1为B,试剂2为D(填字母).
A.KMnO4 B.H2O2 C.NaOH D.Cu2(OH)2CO3
(2)固体A的化学式为Fe(OH)3.为使A完全沉淀,调节pH的范围是[3.7,5.4).
(3)操作Ⅰ依次为加热浓缩、冷却结晶、过滤.操作Ⅰ整个过程中用到的硅酸盐仪器除了漏斗、烧杯、酒精灯外,还需要蒸发皿、玻璃棒.
(4)使用无水乙醇代替水进行洗涤的优点是减少CuCl2•2H2O 因溶于水而损失,且有利于后续干燥.
Ⅰ、利用废液再生刻蚀液

(1)试剂2是HCl,固体B是Cu,通入的气体C是Cl2.(填化学式)
(2)写出加入试剂1发生反应的离子方程式:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu.
Ⅱ、利用废液制备CuCl2•2H2O晶体
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |

(1)为确保产品的纯度,试剂1为B,试剂2为D(填字母).
A.KMnO4 B.H2O2 C.NaOH D.Cu2(OH)2CO3
(2)固体A的化学式为Fe(OH)3.为使A完全沉淀,调节pH的范围是[3.7,5.4).
(3)操作Ⅰ依次为加热浓缩、冷却结晶、过滤.操作Ⅰ整个过程中用到的硅酸盐仪器除了漏斗、烧杯、酒精灯外,还需要蒸发皿、玻璃棒.
(4)使用无水乙醇代替水进行洗涤的优点是减少CuCl2•2H2O 因溶于水而损失,且有利于后续干燥.
2.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述正确的是( )
| A. | NH4H是共价化合物 | B. | NH4H溶于水,所形成的溶液显碱性 | ||
| C. | NH4H与水反应时,水作还原剂 | D. | NH4H中的H元素只有一种化合价 |