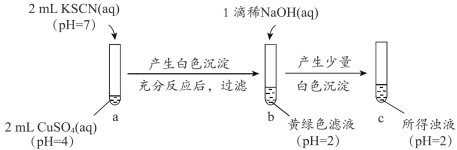
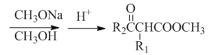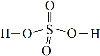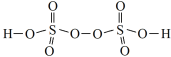题目内容
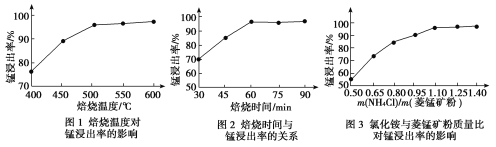
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置:
(1)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极的电极反应式为__________。当反应中收集到标准状况下224 mL气体时,消耗的电极质量为________g。
(2)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入甲烷燃料,采用氢氧化钠溶液为电解液,则电子从____极流出,a极的电极反应式为________。
(3)质量相同的铜棒和铁棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为24 g,则导线中通过的电子的物质的量_______mol。
(4)学法题:总结原电池负极的判断方法___________(至少2条)。
【答案】Al-3e-+4OH-=AlO2-+2H2O 0.18 a CH4-8e-+10OH-=CO32-+7H2O 0.4 电流的方向、电子的流向等
【解析】
(1)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,Al作负极,失电子,负极反应为:Al-3e-+4OH-=AlO2-+2H2O,总反应为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑,每产生3mol氢气,消耗2molAl,当收集到224mL气体,即物质的量n=![]() =0.01mol时,消耗Al的物质的量=
=0.01mol时,消耗Al的物质的量=![]() mol,质量=
mol,质量=![]() mol×27g/mol=0.18g,故答案为:Al-3e-+4OH-=AlO2-+2H2O;0.18g;
mol×27g/mol=0.18g,故答案为:Al-3e-+4OH-=AlO2-+2H2O;0.18g;
(2)燃料电池中,燃料在负极失电子,所以,a极是负极,则电子从a极流出,a极反应式为:CH4-8e-+10OH-=CO32-+7H2O,故答案为:a;CH4-8e-+10OH-=CO32-+7H2O;
(3)Fe作负极,失电子,负极质量减小,Cu作正极,Cu2+在正极得电子生成Cu,正极质量增大,总反应为:Fe+Cu2+=Cu+Fe2+ ~ 2e-,每转移2mol电子,两极质量相差(56+64)g=120g,当两极相差24g时,转移电子物质的量=![]() =0.4mol,故答案为:0.4;
=0.4mol,故答案为:0.4;
(4)原电池的工作原理为:负极失电子,化合价升高,发生氧化反应,正极得电子,化合价降低,发生还原反应,电子从负极流出,正极流进,电流方向与电子流向相反,所以,判断正负极的方法有:电流的方向、电子的流向、化合价升降、氧化反应和还原反应等,故答案为:电流的方向、电子的流向等。

【题目】过硫酸(H2S2O8)为无色晶体,易溶于水,在热水中易水解。
物质 | 硫酸 | 过硫酸 |
结构式 |
|
|
(1)依据硫酸和过硫酸的结构式,下列说法正确的是______(填序号)。
a.硫酸和过硫酸均为共价化合物
b. 过硫酸分子中含有与过氧化氢分子中相同的化学键
c. 过硫酸分子可看作2个硫酸分子脱去1个水分子
(2)工业上利用过硫酸铵制备过氧化氢的一种方法如下图。

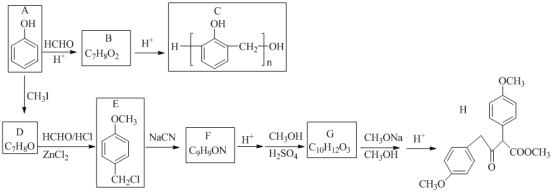
①电解法制(NH4)2S2O8过程中,得到S2![]() 的电极反应式是______。
的电极反应式是______。
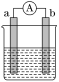
② 其他条件一定,电解相同时间后,测得生成液中S2![]() 含量随温度变化如图。电解时通常控制15℃而不用更低温度的原因:______。
含量随温度变化如图。电解时通常控制15℃而不用更低温度的原因:______。
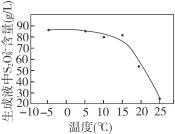
③X的化学式是______。
④过硫酸盐的水解反应______(填“属于”或“不属于”)氧化还原反应。
⑤下图中a~e表示S2![]() 中的部分化学键,则S2
中的部分化学键,则S2![]() 发生水解反应时断裂的化学键是______(选填字母)。
发生水解反应时断裂的化学键是______(选填字母)。
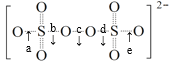
(3)过硫酸钾氧化法可用于分析锰钢中Mn元素的含量:取样品a g,加入过量浓硝酸,在加热条件下将Mn溶出,再用b L 过硫酸钾溶液将溶出的Mn2+全部转化为![]() ,检测
,检测![]() 浓度,计算得出样品中Mn元素的质量分数为c。
浓度,计算得出样品中Mn元素的质量分数为c。
①该实验条件下氧化性:S2![]() ______
______![]() (填“>”或“<”)。
(填“>”或“<”)。
②该过程中过硫酸钾溶液的浓度至少是______mol/L(用含a、b、c的代数式表示)。
【题目】侯氏制碱法是中国传统工业方法,此方法制备Na2CO3一直在工业上沿用至今。其原理如下:①NH3+H2O+CO2=NH4HCO3
②NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
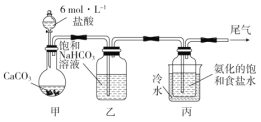
(1)装置丙中反应的化学方程式为____。
(2)装置乙的作用是___。为防止污染空气,尾气中的___需要进行吸收处理。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有___。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

选择的装置(填编号) | 实验现象 | 实验结论 |
___ | ___ | 样品中含NaHCO3 |
(5)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2g。则该纯碱样品的纯度为___。