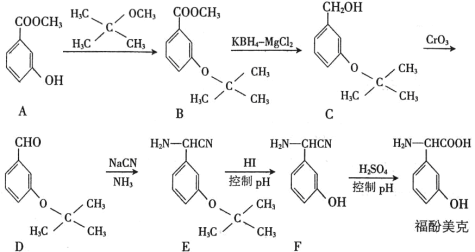
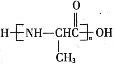
题目内容
【题目】某小组研究SCN-分别与Cu2+和Fe3+的反应。实验中:c(KSCN) = 0.1 mol/L;c[Fe2(SO4)3] = 0.025 mol/L;c(CuSO4) = 0.05 mol/L。
Ⅰ. KSCN溶液与CuSO4溶液反应,实验如下。

资料:ⅰ.Cu2+可与SCN-反应生成CuSCN白色沉淀和(SCN)2。
ⅱ.(SCN)2称为“拟卤素”,在水溶液中呈黄色;(SCN)2的化学性质与Cl2相似,可与水、碱等发生反应。
(1)a中CuSO4溶液显酸性的原因是______(用离子方程式表示)。
(2)a→b中试管内溶液pH减小,可能的原因是______。
(3)b→c产生沉淀的原因是______。
Ⅱ. 同学们根据相同条件下氧化性:Fe3+>Cu2+,预测Fe3+与SCN-也可发生类似a中的氧化还原反应,进行如下实验。
(4)向Fe2(SO4)3溶液中滴入少量KSCN溶液,观察到______,表明发生了反应:Fe3+ + 3SCN- ![]() Fe(SCN)3。
Fe(SCN)3。
(5)基于(4)继续实验:用Fe2(SO4)3溶液、KSCN溶液与石墨电极、电压表、盐桥等组装成原电池,电压表指针几乎不偏转。该实验的目的是______。
(6)查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析a中反应发生的原因:生成CuSCN沉淀使Cu2+的氧化性增强,并补充实验进一步证明。补充的实验是______。
(7)取(4)中反应后溶液,逐滴加入K3[Fe(CN)6]溶液,产生蓝色沉淀,并且沉淀量逐渐增多。该实验结果与(5)中实验结果不一致,解释原因:______。
(8)为进一步证实(7)中的解释,在以上实验的基础上补充实验,其操作及现象是___。
【答案】Cu2++2H2O ![]() Cu(OH)2+2H+ 生成(SCN)2与水反应所得HSCN为强酸,使溶液pH减小 NaOH与(SCN)2反应,使溶液中c(SCN-)增大,与Cu2+继续反应生成少量CuSCN 溶液变为红色 在无Fe3++3 SCN-
Cu(OH)2+2H+ 生成(SCN)2与水反应所得HSCN为强酸,使溶液pH减小 NaOH与(SCN)2反应,使溶液中c(SCN-)增大,与Cu2+继续反应生成少量CuSCN 溶液变为红色 在无Fe3++3 SCN-![]() Fe(SCN)3干扰时,证明Fe3+能否将SCN-氧化 用CuSO4溶液、KSCN溶液与石墨电极、电压表、盐桥等组装成原电池 滴入K3[Fe(CN)6]溶液时,与Fe2+生成沉淀,使Fe3+的氧化性增强 在(5)的原电池中,向盛有Fe2(SO4)3溶液的容器中滴入少量K3[Fe(CN)6]溶液,指针发生明显偏转,且该侧电极为正极
Fe(SCN)3干扰时,证明Fe3+能否将SCN-氧化 用CuSO4溶液、KSCN溶液与石墨电极、电压表、盐桥等组装成原电池 滴入K3[Fe(CN)6]溶液时,与Fe2+生成沉淀,使Fe3+的氧化性增强 在(5)的原电池中,向盛有Fe2(SO4)3溶液的容器中滴入少量K3[Fe(CN)6]溶液,指针发生明显偏转,且该侧电极为正极
【解析】
Cu2+可与SCN-反应生成CuSCN白色沉淀和(SCN)2,充分反应后过滤,得到(SCN)2溶液,其水溶液呈黄色;(SCN)2与NaOH发生反应,(SCN)2+2NaOH=NaSCN+NaSCNO+H2O。
I、(1)CuSO4溶液显酸性的原因是Cu2++2H2O ![]() Cu(OH)2+2H+;
Cu(OH)2+2H+;
(2)根据题给资料,a到b试管中pH减小的可能原因是:卤素单质能和水反应生成两种酸(氟气除外),所以SCN-生成的(SCN)2也能和水反应生成两种酸,所得HSCN为强酸,使溶液pH减小;
(3)根据题给资料,b到c产生沉淀的原因是:(SCN)2与NaOH发生反应,(SCN)2+2NaOH=NaSCN+NaSCNO+H2O,使溶液中c(SCN)-增大,与Cu2+继续反应生成少量CuSCN。
II、(4)向Fe2(SO4)3溶液中滴入少量KSCN溶液,观察到溶液变为红色,表明发生了反应:Fe3+ + 3SCN- ![]() Fe(SCN)3。
Fe(SCN)3。
(5)基于(4)继续实验:用Fe2(SO4)3溶液、KSCN溶液与石墨电极、电压表、盐桥等组装成原电池,电压表指针几乎不偏转。该实验的目的是探究在无Fe3++3 SCN-![]() Fe(SCN)3干扰时,证明Fe3+能否将SCN-氧化;
Fe(SCN)3干扰时,证明Fe3+能否将SCN-氧化;
(6)根据查阅的资料和分析的原因,设计的实验要排除CuSCN的干扰,所以补充的实验:用CuSO4溶液、KSCN溶液与石墨电极、电压表、盐桥等组装成原电池;
(7)取(4)中反应后溶液,逐滴加入K3[Fe(CN)6]溶液,产生蓝色沉淀,并且沉淀量逐渐增多。根据(6)中查阅的资料可知,该实验结果与(5)中实验结果不一致是因为:滴入K3[Fe(CN)6]溶液时,与Fe2+生成沉淀,使Fe3+的氧化性增强;
(8)为了证实(7)中的解释,采用对比实验,在(5)的原电池中,向盛有Fe2(SO4)3溶液的容器中滴入少量K3[Fe(CN)6]溶液,指针发生明显偏转,且该侧电极为正极。

【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。