题目内容
【题目】侯氏制碱法是中国传统工业方法,此方法制备Na2CO3一直在工业上沿用至今。其原理如下:①NH3+H2O+CO2=NH4HCO3
②NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。

(1)装置丙中反应的化学方程式为____。
(2)装置乙的作用是___。为防止污染空气,尾气中的___需要进行吸收处理。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有___。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

选择的装置(填编号) | 实验现象 | 实验结论 |
___ | ___ | 样品中含NaHCO3 |
(5)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2g。则该纯碱样品的纯度为___。
【答案】NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl 除去CO2中的HCl气体 氨气(NH3) 过滤、洗涤、灼烧 AB(或AC或ACB) B变浑浊(或C变蓝或C变蓝、B变浑) ![]() %
%
【解析】
Ⅰ.装置甲是制备二氧化碳,气体中含有氯化氢气体对后续实验产生干扰,需要除去;装置乙为除去CO2中的HCl气体的装置,装置丙中是氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体,通过过滤得到晶体洗涤灼烧得到碳酸钠,据此分析解答;
Ⅱ.(4)碳酸氢钠不稳定,加热分解生成碳酸钠、二氧化碳与水,可以利用澄清石灰水检验二氧化碳,或利用无水硫酸铜检验水,判断样品中含有碳酸氢钠;
(5)样品中碳酸钠与氯化钙反应生成碳酸钙沉淀,根据碳酸钙的质量,结合元素守恒计算样品中碳酸钠的质量,进而计算该纯碱样品的纯度。
Ⅰ.(1)装置丙中,氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应的方程式为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,故答案为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;
(2)利用盐酸制取二氧化碳时二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应,所以通过装置乙中饱和碳酸氢钠的溶液,可以除掉二氧化碳中的氯化氢气体;尾气为氨气、二氧化碳,氨气是有刺激性气味的气体,为大气污染物,为防止污染空气,尾气中含有的氨气(或NH3)需要进行吸收处理,可用硫酸吸收,故答案为:除去CO2中的HCl气体;氨气(或NH3);
(3)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠沉淀和氯化铵,通过过滤分离出碳酸氢钠,并进行洗涤,碳酸氢钠受热发生的反应为:2NaHCO3![]() Na2CO3+CO2↑+H2O,灼烧得到碳酸钠,故答案为:过滤、洗涤、灼烧;
Na2CO3+CO2↑+H2O,灼烧得到碳酸钠,故答案为:过滤、洗涤、灼烧;
Ⅱ.(4)由于碳酸氢钠加热分解生成碳酸钠、二氧化碳与水,利用二氧化碳使澄清石灰水变浑浊,或利用无色无水硫酸铜吸水变蓝色,可以判断样品中是否含有碳酸氢钠,故选择的装置为:“AB”或“AC”或“ACB”,对应的现象为:“B变浑浊”或“C变蓝”或“C变蓝、B变浑”,故答案为:AB(或AC或ACB);B变浑浊(或C变蓝或C变蓝、B变浑);
(5)样品中碳酸钠与氯化钙反应生成碳酸钙沉淀,过滤、洗涤、干燥,称量碳酸钙的质量为m2g,根据碳酸根守恒可知样品中n(碳酸钠)=n(碳酸钙)=![]() =
=![]() mol,故m(碳酸钠)=
mol,故m(碳酸钠)=![]() mol×106g/mol=
mol×106g/mol=![]() g,该纯碱样品的纯度为
g,该纯碱样品的纯度为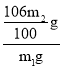 ×100%=
×100%=![]() %,故答案为:
%,故答案为:![]() %。
%。