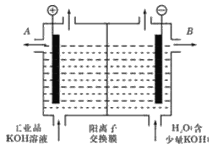
题目内容
【题目】根据下列图示所得推论正确的是
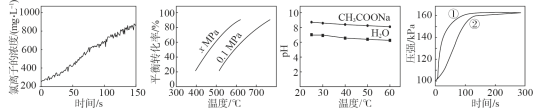
A.甲是新制氯水光照过程中氯离子浓度的变化曲线,推断次氯酸分解生成了HCl和O2
B.乙是C4H10(g)![]() C4H8(g)+H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的H>0、x>0.1
C4H8(g)+H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的H>0、x>0.1
C.丙是0.5mol/L CH3COONa溶液及水的pH随温度的变化曲线,说明随温度升高,CH3COONa溶液中c(OH-)减小
D.丁是0.03g镁条分别与2mL 2mol/L盐酸和醋酸反应过程中密闭容器内气体压强随时间的变化曲线,推断①代表盐酸与镁条的反应
【答案】D
【解析】
A、在氯水中,存在反应:Cl2+H2O![]() H++Cl-+HClO,Cl-浓度的升高说明平衡正向移动,是因为HClO不稳定分解,但是并不能推断出HClO分解产生了O2,A错误;
H++Cl-+HClO,Cl-浓度的升高说明平衡正向移动,是因为HClO不稳定分解,但是并不能推断出HClO分解产生了O2,A错误;
B、同一压强下,温度升高,平衡转化率升高,则平衡正向移动,H>0;同一温度下,压强增大,平衡逆向移动,平衡转化率降低,则x<0.1;B错误;
C、盐类的水解和弱电解质的电离都是吸热反应,温度升高,水的离子积增大,水中的c(H+)增大,pH降低;温度升高,CH3COONa的水解平衡正向移动,c(OH-)增大,由于c(H+)=![]() ,Kw增大的更多一些,使得c(H+)也增大一些[c(H+)没有c(OH-)增大得多],溶液pH呈小幅度的减小,C错误;
,Kw增大的更多一些,使得c(H+)也增大一些[c(H+)没有c(OH-)增大得多],溶液pH呈小幅度的减小,C错误;
D、盐酸和醋酸的体积、浓度均相同,则HCl和醋酸的物质的量也相同,故这两个容器中产生的H2的量相同,最终容器内的压强也相同;HCl是强电解质,醋酸是弱电解质,则醋酸溶液的H+的浓度较低,其反应速率也较低,故①代表盐酸与镁条的反应,②代表醋酸与镁条的反应,D正确;
故选D。

【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案。
【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(1)设计该实验方案的目的是:探究同周期元素的__________________________。
(2)实验①的现象是 ,反应的化学方程式是 。
【实验二】 为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如下图。
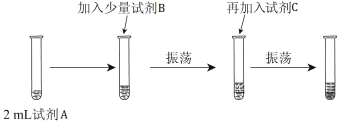
(3)试剂A是 ;试剂B是 ;试剂C是 。
(4)试剂C在实验中所起的作用是 ,加入C振荡、静置后看到的现象是: 。以上反应可以证明Cl2的非金属性_______(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:_______________。
【题目】某学习小组同学根据影响化学反应速率的因素进行实验验证,其设计的实验方案如下:请你帮他们把表填写完整,并做出评价。
(1)甲同学验证还原性:I->Br-
实验步骤 | 实验现象 | 实验结论及离子反应式 |
| 逐滴加入的同时振荡,观察CCl4层的颜色: 甲___ 乙___; 乙中CCl4层颜色明显变化的快。 | 离子方程式: 甲__ 乙__ 结论:验证成立,还原性,I->Br- |
(评价)甲同学设计的实验方案是__(填“合理”或“不合理”),理由是__。
(3)乙同学验证固体反应物的颗粒大小的对反应速率影响
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为__是符合的。