题目内容
【题目】下列说法正确的是
A.0.1mol/L NaHSO3溶液pH=5.6,溶液中粒子浓度 c (HSO3-)> c (H2SO3)>c (SO32-)
B.将Na2CO3固体溶于水配成溶液,再向溶液中加水,由水电离出的c(H+)·c(OH-)增大
C.碳酸氢钠溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D.等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合: <
<
【答案】C
【解析】
A.0.1mol/L NaHSO3溶液pH=5.6,说明溶液显酸性电离程度大于水解程度,溶液中粒子浓度c(HSO3-)>c(SO32-)>c(H2SO3),故A错误;
B.加水稀释促进碳酸钠水解,则由水电离出的n(H+)、n(OH-)都增大,但氢离子、氢氧根离子物质的量增大倍数小于溶液体积增大倍数,因此由水电离出的c(H+)·c(OH-)减小,故B错误;
C.碳酸氢钠溶液中存在电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),物料守恒:c(Na+)=c(CO32-)+c(HCO3-)+(H2CO3),则c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故C正确;
D.等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合: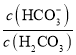 <
<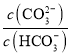
D.等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合,溶液呈碱性,H2CO3的电离平衡常数关系Ka1>Ka2,混合溶液中c(H+)值一定,则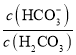 =
=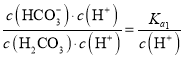 ,
,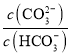 =
=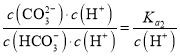 ,由于Ka1>Ka2,则
,由于Ka1>Ka2,则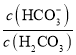 >
>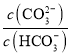 ,故D错误;
,故D错误;
故答案选C。

练习册系列答案
 能考试全能100分系列答案
能考试全能100分系列答案
相关题目