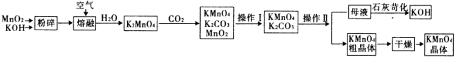
题目内容
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案。
【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(1)设计该实验方案的目的是:探究同周期元素的__________________________。
(2)实验①的现象是 ,反应的化学方程式是 。
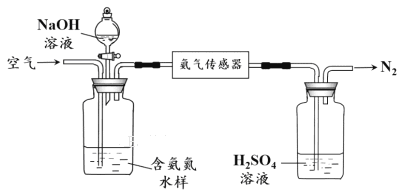
【实验二】 为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如下图。
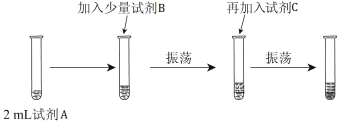
(3)试剂A是 ;试剂B是 ;试剂C是 。
(4)试剂C在实验中所起的作用是 ,加入C振荡、静置后看到的现象是: 。以上反应可以证明Cl2的非金属性_______(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:_______________。
【答案】(1)性质(或金属性与非金属性)的递变规律 (2)生成浅黄色沉淀;Na2S+Cl2=2NaCl+S↓
(3)NaBr溶液 氯水 四氯化碳 (4)萃取生成的溴,使现象更明显
液体分成两层,上层接近无色、下层为橙色 强于 Cl2+2Br-=2Cl-+Br2
【解析】
试题分析:【实验一】(1)由实验步骤可知,实验序号①比较S、Cl的非金属性强弱,实验序号②③,比较Mg、Al的金属性强弱,所以实验目的是元素性质(或金属性与非金属性)的递变规律;
(2)氯水与硫化钠反应生成S与NaCl,反应方程式为Na2S+Cl2=2NaCl+S↓,实验现象是生成浅黄色沉淀;
【实验二】(3)要想比较氯气和溴单质的氧化性大小,可做如下实验:试剂A,取少量溴化钠反应→加适量氯水(振荡,溶液由黄绿色变成橙色)→加入四氯化碳(振荡)→现象(溶液分层,下层橙红色,上层无色)→说明氯气和溴离子反应,能证明氯气的氧化性大于溴;
(4)溴单质在四氯化碳中的溶解度大于在水中的溶解度,水和四氯化碳是互不相溶的,所以试剂C在实验中所起的作用是萃取生成的溴,使现象更明显。加入C振荡、静置后看到的现象是:液体分成两层,上层接近无色、下层为橙色;氯气能将溴单质置换出来,氯气的氧化性大于溴,离子方程式为Cl2+2Br-=2Cl-+Br2。

 阅读快车系列答案
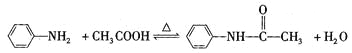
阅读快车系列答案【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂和防腐剂、乙酰苯胺的制备原理为
实验参数
名称 | 相对分 | 性状 | 密度(g/mL) | 沸点( | 溶解性 | |
苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
实验装置如图所示(部分仪器及夹持装置已略去)。
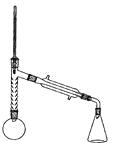
注:①刺型分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。②苯胺易被氧化。
实验步骤:
步骤1:在100mL圆底烧瓶中加入无水苯胺9.3mL、冰醋酸18.4mL、锌粉0.1g和少量沸石,安装好仪器后,对圆底烧瓶均匀加热,使反应液在微沸状态下回流,调节加热温度,使温度计温度控制在105![]() 左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步骤2:在搅拌下,趁热将蒸馏烧瓶中的液体以细流状倒入盛有冰水的100mL烧杯中,快速搅拌,乙酰苯胺结晶析出,烧杯内试剂冷却至室温后,进行抽滤、洗涤、干燥,可得到乙酰苯胺粗品。
步骤3:将乙酰苯胺粗品进行重结晶,待结晶完全后抽滤,尽量压甘干滤饼。将产品置于干净的表面皿中晾干,称重,计算产率、
请回答下列问题:
(1)实验中加入锌粉的目的是_____________________。
(2)从化学平衡的角度分析,控制温度计的温度在105![]() 左右的原因是______________。
左右的原因是______________。
(3)通过_____________可判断反应基本完成、
(4)步骤1加热可用_____________(填“水浴”或“油浴”)。
(5)洗涤乙酰苯胺粗品最合适的方法是__________________(填字母)。
A.用少量冷水洗
B.用少量热水洗
C.先用冷水洗,再用热水洗
D.用酒精洗
(6)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,______________,再将滤液冷却结晶。
(7)该实验最终得到产品9.1g,则乙酰苯胺的产率是____________(小数点后保留两位数字。)