题目内容
【题目】白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
(1)2P+5CuSO4+8H2O![]() 5Cu+2H3PO4+5H2SO4
5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4 +24H2O![]() 5Cu3P+6H3PO4+15H2SO4
5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是( )
A. 上述两个反应中,水既不是氧化剂也不是还原剂
B. 上述两个反应中,氧化剂都只有硫酸铜
C. 上述两个反应中,氧化产物都是H3PO4
D. 反应(2)中,1molCuSO4可氧化1/5molP
【答案】B
【解析】
A. 上述两个反应中,水中各元素化合价均不变,所以水既不是氧化剂也不是还原剂,故A正确;
B. 2P+5CuSO4+8H2O![]() 5Cu+2H3PO4+5H2SO4反应中,氧化剂只有CuSO4;11P+15CuSO4 +24H2O
5Cu+2H3PO4+5H2SO4反应中,氧化剂只有CuSO4;11P+15CuSO4 +24H2O![]() 5Cu3P+6H3PO4+15H2SO4反应中,氧化剂是P、CuSO4,故B错误;
5Cu3P+6H3PO4+15H2SO4反应中,氧化剂是P、CuSO4,故B错误;
C. 上述两个反应中,都是P元素化合价升高,氧化产物都是H3PO4,故C正确;
D. 反应(2) 11P+15CuSO4 +24H2O![]() 5Cu3P+6H3PO4+15H2S中,15molCuSO4参加反应,铜离子得到15mol电子,所以15molCuSO4氧化3molP,当1molCuSO4可氧化1/5molP,故D正确。选B。
5Cu3P+6H3PO4+15H2S中,15molCuSO4参加反应,铜离子得到15mol电子,所以15molCuSO4氧化3molP,当1molCuSO4可氧化1/5molP,故D正确。选B。

 阅读快车系列答案
阅读快车系列答案【题目】实验室用CH3CH2OH分两步制备1,2-二溴乙烷现用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
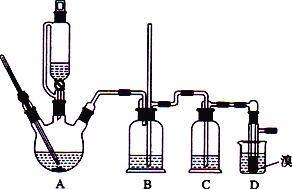
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm-3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A中发生的化学方程式为_________________________________,反应类型为________,在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________(填字母)。
a 引发反应 b减少副产物乙醚生成 c 防止乙醇挥发 d加快反应速率
(2)在装置C中应加入________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3) 装置D中实验现象为_______________。
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置D,其主要目的是____________________________。