题目内容
【题目】请回答下列问题
(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体的离子方程式为_______________________。
(2)Ca(OH)2的电离方程式为_______________。
(3)现有下列物质:①干冰②NaHCO3晶体③氨水④纯醋酸⑤FeCl3溶液⑥铜⑦蔗糖⑧熔化的NaCl,其中属于非电解质的是___________(填序号,下同),属于强电解质的有____________,属于弱电解质的有________________,能导电的物质有________________。
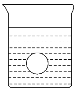
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀H2SO4至恰好完全反应。在此实验过程中,此实验中观察到的现象有___________________________________________。
【答案】![]()
![]() ①⑦ ②⑧ ④ ③⑤⑥⑧ 溶液中有白色沉淀生成;塑料小球沉入水中
①⑦ ②⑧ ④ ③⑤⑥⑧ 溶液中有白色沉淀生成;塑料小球沉入水中
【解析】
(1)通过FeCl3溶液制取Fe(OH)3胶体的离子方程式为![]() ;
;
(2)Ca(OH)2为强电解质,其电离方程式为![]() ;
;
(3)①干冰是固态二氧化碳,不能自身发生电离,不能导电,属于非电解质;
②NaHCO3晶体不存在自由移动的离子,不能导电,溶于水发生完全电离,属于强电解质;
③氨水中含有自由移动的离子,能导电,属于混合物,不属于电解质,也不属于非电解质;
④纯醋酸中不存在自由移动的离子,不导能电,溶于水部分电离,属于弱电解质;
⑤FeCl3溶液中含有自由移动的离子,能导电,属于混合物,不属于电解质,也不属于非电解质;
⑥铜是金属单质,含有自由移动的电子,能导电,不是电解质,也不是非电解质;
⑦蔗糖自身不能电离,不导能电,溶于水也不能电离,属于非电解质;
⑧熔化的NaCl中存在自由移动的离子,能导电,完全电离,属于强电解质。所以,属于非电解质的是①⑦,属于强电解质的有②⑧,属于弱电解质的有④,能导电的物质有③⑤⑥⑧;
(4)根据题意,发生反应的化学方程式为Ba(OH)2+H2SO4=BaSO4↓+2H2O,所以有白色沉淀生成,恰好完全反应后,液体只剩下水,密度降低,塑料小球会下降到烧杯底部;故答案为:溶液中有白色沉淀生成;塑料小球沉入水中。

 名校课堂系列答案
名校课堂系列答案【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是

编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③