题目内容
【题目】氯化银胶体中的分散质粒子实际上是一个个由很多“AgCl”结合而成的集合体,向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔现象,则下列分析正确的是

A.该区域是A,该区域中AgCl的直径最小
B.该区域是B,该区域中AgCl的直径介于A、C之间
C.该区域是C,该区域中AgCl的直径最大
D.各区域AgCl的大小相同,但只有B区域中分散质的大小介于1~100nm之间
【答案】D
【解析】
试题分析:AgCl属于难溶物,静置后A、B、C三个区域中,A区域应为溶液,C区域为沉淀,只有B区域属于胶体。胶体中分散质粒子(即题中所述“集合体”)的大小介于1~100nm之间,单个的AgCl直径都相等,答案选D。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确是
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确是
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol·L-1 | 0.010 | 0.020 | 0.020 |
c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.020[ |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
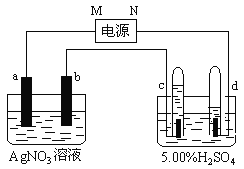
【题目】某课外活动小组准备用如下图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
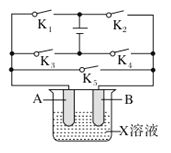
A电极 | B电极 | X溶液 | |
甲 | Cu | Zn | H2SO4 |
乙 | Pt | Pt | CuCl2 |
丙 | Fe | Cu | ? |
(1)甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为______________。
(2)乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为___________________。实验时应闭合的电键的组合是________(从下列五项中选择所有可能组合,第(3)小题也在这五项中选择)。
A.K1和K2
B.K1和K3
C.K1和K4
D.K2和K3
E.K2和K4
(3)丙同学准备在Fe上镀Cu,选择了用某种盐来配制电镀液,则该盐中应含的阳离子为________,实验时,应闭合的电键的组合是________。
【题目】实验室用右图装置完成下表所列的四个实验,不能达到实验目的是
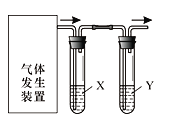
选项 | 实验目的 | 试剂X | 试剂Y |
A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
B | 检验FeSO4受热分解产生的气体中有SO3和SO2 | BaCl2溶液 | 品红溶液 |
C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |