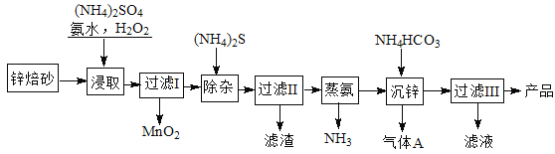
题目内容
【题目】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)砷的氢化物的化学式为________,其稳定性比磷的氢化物____(填“强或弱”)。已知H3AsO3是两性偏酸性的化合物,它与硫酸反应的化学方程式为 。NaHAsO3溶液呈碱性,该溶液中c(H2AsO3-) C(AsO33-)(填“>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷的过程是:先在空气中煅烧使其转化为砒霜(As2O3),然后用焦炭还原。写出焦炭还原时发生反应的化学方程式: 。砒霜有剧毒,卫生防疫分析中鉴定的方法是:先将试样与锌、硫酸混合在一起反应,将生成的气体导入到热玻璃管中热解,若玻璃管中产生亮黑色的“砷镜”,则说明试样中含有As2O3。写出上述鉴定过程中有关反应的化学方式: 。
②“砷镜”可被漂白精氧化为H3AsO4,反应中还原剂与氧化剂物质的量之比为 。
(3)已知砷酸(H3AsO4)是三元酸,有较强的氧化性。
①常温下砷酸的K1=6×10-3、K2=1×10-7,则NaH2AsO4溶液的pH为____7。(填“>”、“<”、“=”),判断依据为___________________________________________________________________。
②某原电池装置如图所示,电池总反应为AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。
AsO33-+I2+2OH-。
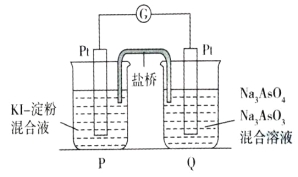
当P池中溶液由无色变成蓝色时,正极上的电极反应式为 。当电流计指针归中后向Q池中加入一定量的NaOH,则电池负极所在的烧杯为 (填“P”或“Q”)。
【答案】(1) AsH3(1分),弱(1分), 2H3AsO3+ 3H2SO4 =As2(SO4)3 +6H2O (1分) , >(1分)
(2)① 2As2O3 + 3C![]() 4As+3CO2↑ (2分);
4As+3CO2↑ (2分);
As2O3+6Zn+6H2SO4=2AsH3 ↑+ 6ZnSO4+ 3H2O(1分) 2AsH3=2As↓+3H2(1分)
② 2:5(1分) (3)①pH<7(1分)
H2AsO4-+H2O![]() H3AsO4+OH-,(1分)Kh=Kw/Ka1=1.0 ×10-14/6×10-3=1.67×10-12 < Ka2(1分)
H3AsO4+OH-,(1分)Kh=Kw/Ka1=1.0 ×10-14/6×10-3=1.67×10-12 < Ka2(1分)
②AsO43-+H2O+2e-=AsO33-+2OH- (2分) Q (1分)
【解析】
试题分析:(1)砷是第四周期第VA族元素,最低负价为-3价,则砷的氢化物化学式为AsH3;磷与砷是同主族,同主族从上到下非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱,则砷的氢化物稳定性更弱;H3AsO3是两性偏酸性的化合物,与硫酸反应生成硫酸砷和水,方程式为2H3AsO3+ 3H2SO4 =As2(SO4)3 +6H2O;Na2HAsO3溶液呈碱性,说明HAsO3—水解大于电离程度,则c(H2AsO3-)>(AsO33-);
(2)①As2O3与焦炭在高温下反应生成As和CO2,方程式为2As2O3 + 3C![]() 4As+3CO2↑;锌、硫酸混合在一起反应生成氢气,氢气与As2O3反应生AsH3,AsH3在热玻璃管中分解成As和H2,反应方程式分别为As2O3+6Zn+6H2SO4=2AsH3 ↑+ 6ZnSO4+ 3H2O、2AsH3=2As↓+3H2;
4As+3CO2↑;锌、硫酸混合在一起反应生成氢气,氢气与As2O3反应生AsH3,AsH3在热玻璃管中分解成As和H2,反应方程式分别为As2O3+6Zn+6H2SO4=2AsH3 ↑+ 6ZnSO4+ 3H2O、2AsH3=2As↓+3H2;
②漂白精的主要成分是NaClO,NaClO将As氧化为H3AsO4,NaClO中氯的化合价降低2价,As的化合价升高5价,则还原剂As与氧化剂NaClO物质的量之比为2:5;
(3)①NaH2AsO4溶液水解呈碱性,电离呈酸性,Kh=Kw/Ka1=1.0×10-14/6×10-3=1.67×10-12<Ka2,水解程度小于电离程度,则NaH2AsO4溶液呈酸性,溶液的pH<7;
②原电池飞正极上发生得电子发生还原反应,电极反应式为AsO43-+H2O+2e-=AsO33-+2OH-;当电流计指针归中后向Q池中加入一定量的NaOH,反应逆向进行,AsO33-失电子被氧化成AsO43-,则Q为电池的负极。

【题目】研究表明,化学反应的能量变化与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据
化学键 | P—P | P—O | O=O | P=O |
键能 kJ·mol-1 | 197 | 360 | 499 | X |
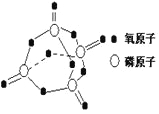
己知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0kJ ,且白磷分子结构为正四面体,4 个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如上图所示,则上表中X为
A.434 B.335 C.237 D.188
【题目】下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)元素⑥的名称为 ;⑨的最高价含氧酸的化学式为 。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为 。
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为 。(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式 。
(5)用电子式表示③和⑨组成的化合物的形成过程 。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式 。