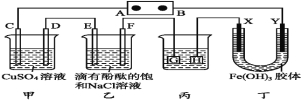
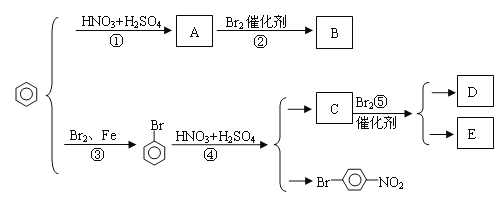
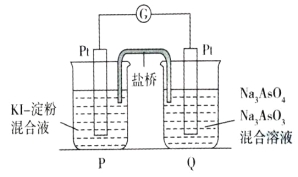
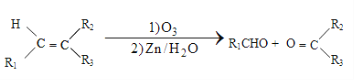题目内容
【题目】氢能的存储是其应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2![]() 2NH3实现储氢和输氢。下列说法正确的是( )
2NH3实现储氢和输氢。下列说法正确的是( )
A.NH3分子中氮原子的轨道杂化方式为sp2杂化
B.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体
C.相同压强下,NH3沸点比PH3的沸点高
D.[Cu(NH3)4]2+中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是___________。
【答案】
(1)M;9;
(2)cd
(3)N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向氟原子,偏离氮原子,使得氮原子上的孤电子对难以与Cu2+形成配位键
【解析】
试题分析:(1)基态Ti2+价电子排布式为:3d2,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道,故答案为:M;9;
(2)a.NH3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对是4,采用sp3杂化,故a错误;b.等电子体为原子数相等和价电子数相等的原子团,NH+4与PH+4、CH4、BH-4均含有5个原子团,且价电子均为8,为等电子体,而ClO-4价电子数为32,不属于等电子体,故b错误;c.分子间存在氢键的熔沸点高,相同压强时,氨气中含有氢键,PH3中不含氢键,所以NH3沸点比PH3高,故c正确;d.提供孤电子对的原子是配原子,[Cu(NH3)4]2+离子中,N原子提供孤对电子,N原子为配原子,故d正确;故答案为:cd;
(3)根据配合物结构判断,Cu2+提供空轨道,NH3和NF3中中心原子N原子提供孤电子对,由于N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键,故答案为:N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】现在部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是________________。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式______ _____。
(3)元素Z与元素T相比,非金属较强的是______________(用元素符号表示);下列表述中能证明这一事实的是___________。
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是_______________(填化学式),理由是_____________。T的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为_______ _ ______。