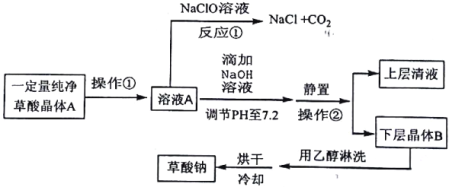
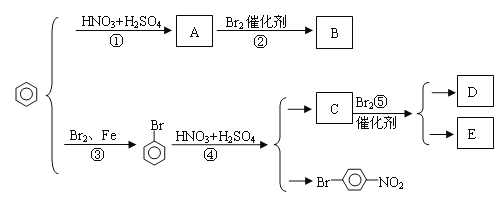
题目内容
【题目】【化学-选修3:物质结构与性质】
X、Y、Z、R为前四周期原子序数依次增大的元素。X的单质与氢气可化合生成气体G.,其水溶液pH>7;Y的原子中最外层电子数是内层电子数的3倍;Z的单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。
请回答下列问题:
(1)Z元素在周期表中的位置________________;其单质的晶体类型是________________;X和Y元素的第一电离能较小的是___________(填元素名称);
(2)在Y、 Z的简单氢化物中,Y的氢化物更易溶于乙醇,其原因是_____________;G在一定条件下可与CO2反应生成一种最常见的氮肥M,M中所含元素原子的杂化方式为_____________;
(3) R单质与Z单质化合的产物J中,R离子的核外电子排布式是_____________;己知J与足量强碱性的NaC1O溶液在一定条件下反应,生成一种具有强氧化性的R的含氧酸根,该反应的离子方程式为_____________;
(4) G分子的立体构型为_______;R可形成化合物R(CO)5,该化合物中所含化学键的类型为_______;
(5) X与硼元素形成的化合物BX,其晶胞结构如图所示,该晶胞中含有的X原子数目为_____________;若最近的X、B原子之间的距离为anm,NA代表阿伏加德罗常数,则该晶体的密度为_____________g/cm
3(列式表示,不必化简)。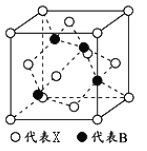
【答案】(1)三周期ⅥA族 分子晶体 氧
(2)H2O可与乙醇形成分子间氢键,而H2S不行;sp2sp3;
(3)[Ar]3d6FeS+6ClO-+4OH-=FeO42-+SO42-+6Cl-+2H2O
(4)三角锥形 共价键、配位键
(5)4![]()
【解析】试题分析:X、Y、Z、R为前四周期原子序数依次增大的元素。X的单质与氢气可化合生成气体G,其水溶液pH>7,可知X为N元素;Y的原子中最外层电子数是内层电子数的3倍,可知Y应为氧元素;Z的单质是一种黄色晶体,则Z为硫元素;R基态原子3d轨道的电子数是4s轨道电子数的3倍,则其价电子结构为3d64s2,可知R为26号元素Fe;
(1)硫元素在周期表中的位置是三周期ⅥA族;硫单质为分子晶体;N原子的2p轨道为半充满结构,第一电离能相对较大,N和O元素的第一电离能较小的是氧元素;
(2)在O、S的简单氢化物中,H2O更易溶于乙醇,其原因是H2O可与乙醇形成分子间氢键,而H2S不行;NH3在一定条件下可与CO2反应生成一种最常见的氮肥M为NH4HCO3,NH4HCO3中所含N原子的杂化方式为sp3,CO32-中碳原子的杂化轨道方式为sp3;
(3) Fe单质与S单质化合的产物FeS中,Fe2+离子的核外电子排布式是1s22s22p63s23p63d6或[Ar]3d6;FeS与足量强碱性的NaC1O溶液在一定条件下反应,生成一种具有强氧化性的FeO42-,该反应的离子方程式为FeS+6ClO-+4OH-=FeO42-+SO42-+6Cl-+2H2O;
(4)NH3分子的立体构型为三角锥形;化合物Fe(CO)5中所含化学键的类型为共价键、配位键;
(5) N与硼元素形成的化合物BN,其晶胞结构如图所示,该晶胞中含有的X原子数目为8×+6×=4;顶点N与相邻的B位于晶胞体对角线上,B到侧面距离均相等,过晶胞中左侧2个B、右侧2个B及面心N作左、右侧面的平行面,可以将体对角线4等份,即顶点N与相邻B距离为晶胞体对角线的,则晶胞体对角线长为4anm,晶胞棱长为![]() nm,晶胞中N原子数目为4、B原子数目为4,故晶胞质量为4×25/NAg,则晶胞密度为4×25/NAg÷(
nm,晶胞中N原子数目为4、B原子数目为4,故晶胞质量为4×25/NAg,则晶胞密度为4×25/NAg÷(![]() nm)3=
nm)3=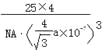 g/cm3。
g/cm3。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案