题目内容
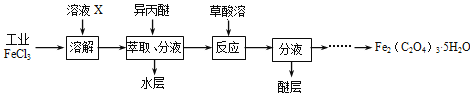
【题目】2Zn(OH)2ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2ZnCO3的工艺流程如下:

请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液呈中性时, c(NH4+) 2c(SO42-)(填“<”、“>”或“=”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×1024,Ksp(CuS)=1.3×1036+;K﹥105化学反应完全]
(5)“沉锌”的离子方程式为 。
(6)“过滤3”所得滤液可循环使用,其主要成分的化学式是 。
【答案】(1)=(2分) (2)搅拌、适当加热(2分)
(3)Mn2++H2O2+2NH3·H2O=MnO2↓+2NH4++2H2O(2分)
(4)可行(1分)ZnS+Cu2=CuS+Zn2+ K=![]() =1.2×1012>>1×105(3分)
=1.2×1012>>1×105(3分)
(5)3Zn2++6HCO3=2Zn(OH)2ZnCO3↓+5CO2↑+H2O(3分)
(6)(NH4)2SO4(2分)
【解析】
试题分析:(1)当(NH4)2SO4,NH3·H2O的混合溶液呈中性时,根据电荷守恒可知c(H+)+c(NH4+)= c(OH-)+2c(SO42-),c(H+)= c(OH-),所以溶液中c(NH4+)= 2c(SO42-)。
(2)“浸取”时为了提高锌的浸出率,可采取的措施有搅拌、适当加热。
(3)“浸取”时加入的NH3·H2O过量,在碱性溶液中双氧水氧化锰离子生成MnO2的离子方程式为Mn2++H2O2+2NH3·H2O=MnO2↓+2NH4++2H2O。
(4)根据方程式ZnS+Cu2=CuS+Zn2+可知该反应的平衡常数K=![]() =
=![]() =1.2×1012>>1×105,因此是可行的。
=1.2×1012>>1×105,因此是可行的。
(5)根据原子守恒可知“沉锌”时生成的A气体是二氧化碳,则反应的离子方程式为3Zn2++6HCO3=2Zn(OH)2ZnCO3↓+5CO2↑+H2O。
(6)“过滤3”所得滤液中含有硫酸铵,可循环使用,硫酸铵的化学式为(NH4)2SO4。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案