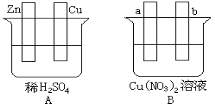
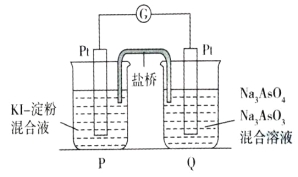
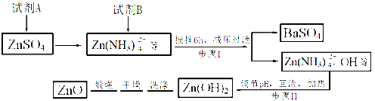
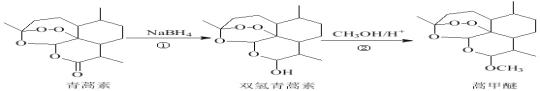
题目内容
【题目】有一种蓝色的晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,立方体的每个棱上均有一个CN-。
(1)根据晶体结构的特点,推出这种蓝色晶体的化学式(用简单整数表示)_____________。
(2)此化学式带何种电荷________,如用Rn+或Rn-与其结合成电中性粒子,此粒子的化学式为__________________________。
【答案】
(1)[FeFe(CN)6]-
(2)负电荷R[FeFe(CN)6]n
【解析】
试题分析:(1)亚铁离子个数=4×![]() ,铁离子个数=4×
,铁离子个数=4×![]() ,CN-离子个数=12×
,CN-离子个数=12×![]() =3,所以其化学式为:[FeFe(CN)6]-,故答案为:[FeFe(CN)6]-;
=3,所以其化学式为:[FeFe(CN)6]-,故答案为:[FeFe(CN)6]-;
(2)根据(1)知,该离子带负电荷,用带正电荷的离子可与其结合成电中性的物质,根据化合物中化合价的代数和为0知,Rn+应该是一个正电荷,所以其化学式为R[FeFe(CN)6],故答案为:负电荷;R[FeFe(CN)6]。

练习册系列答案
相关题目