题目内容
3.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.它可以按下列方法制备:SiO2$\frac{\underline{\;\;\;①C\;\;\;}}{高温}$Si(粗)$\frac{\underline{\;②HCl\;}}{300℃}$SiHCl3$\frac{\underline{\;\;\;③过量H_{2}\;\;\;}}{1000~1100}$Si(纯)
(1)写出步骤①的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)步骤②经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3的主要化学操作的名称是蒸馏或分馏;
SiHCl3和SiCl4一样,遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,试写出其水解的化学方程式:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
分析 (1)根据SiO2与碳反应生成一氧化碳和硅;
(2)根据熔沸点的不同实现物质分离的方法为蒸馏或分馏;SiHCl3水解生成硅酸、氢气和氯化氢.
解答 解:(1)工业上用焦炭在高温下置换二氧化硅中的硅来制备粗硅,方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(2)SiHCl3(沸点33.0℃)、SiCl4(沸点57.6℃)、HCl(沸点-84.7℃),他们的沸点不同,根据沸点的不同实现物质分离的方法为蒸馏或分馏;SiHCl3水解生成硅酸、氢气和氯化氢,反应方程式为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑,
故答案为:蒸馏或分馏;SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
点评 本题考查了硅的制备的有关知识,题目难度中等,掌握实验原理的解题的关键,比较容易.

练习册系列答案
相关题目
1.关于常温下0.1mol/L氨水(pH=11)的下列说法正确的是( )
| A. | 根据题中信息,可推断氨水显弱碱性 | |
| B. | 加水稀释过程中,c(H+)/c(OH-) 的值减小 | |
| C. | 与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-向右移动 |
2.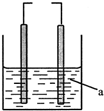 如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )
如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )
①2H++2e→H2↑ ②O2+4e+2H2O→4OH- ③2Cl--2e→Cl2↑
 如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )
如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )①2H++2e→H2↑ ②O2+4e+2H2O→4OH- ③2Cl--2e→Cl2↑
| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
19.向等物质的量浓度的NaOH和Ca(OH)2的混合液中通入一定量CO2.下列离子方程式与事实不相符的是( )
| A. | OH-+CO2→HCO3- | |
| B. | 2OH-+CO2→CO32-+H2O | |
| C. | Ca2++2OH-+CO2→CaCO3↓+H2O | |
| D. | Ca2++4OH-+2CO2→CaCO3↓+CO32-+2H2O |
6. 如图为元素周期表中短周期的一部分,下列有关X、Y、Z、W、T五种元素的叙述中错误的是( )
如图为元素周期表中短周期的一部分,下列有关X、Y、Z、W、T五种元素的叙述中错误的是( )
 如图为元素周期表中短周期的一部分,下列有关X、Y、Z、W、T五种元素的叙述中错误的是( )
如图为元素周期表中短周期的一部分,下列有关X、Y、Z、W、T五种元素的叙述中错误的是( )| A. | X与Y形成的阴离子只有XY32- | |
| B. | Z元素的最高价氧化物对应水化物的酸性最强 | |
| C. | 六种元素分别形成的单质晶体中,X的熔、沸点可能最高 | |
| D. | 这五种元素两两组合,形成只有极性键的非极性分子的物质数大于3 |
15.下列几种物质不能长期暴露在空气中的是( )
| A. | 水晶 | B. | 水玻璃 | C. | 盐酸 | D. | 石英 |
12.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | CO和 N2为等电子体,22.4L的CO气体和1mol N2所含的电子数相等 | |
| B. | 1L密度为1.84g•cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA | |
| C. | 在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA | |
| D. | 在标准状况下,30g福尔马林和22.4L三氧化硫所含氧原子数之比为1:3 |
13.m mol乙炔跟n mol氢气在密闭容器中反应,当其达到平衡时,生成p mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
| A. | (3m+n)mol | B. | ($\frac{5}{2}m+\frac{n}{2}•3p$)mol | C. | (3m+n+2p)mol | D. | ($\frac{5}{2}m+\frac{n}{2}$)mol |