题目内容
1.关于常温下0.1mol/L氨水(pH=11)的下列说法正确的是( )| A. | 根据题中信息,可推断氨水显弱碱性 | |
| B. | 加水稀释过程中,c(H+)/c(OH-) 的值减小 | |
| C. | 与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-向右移动 |
分析 如果是强电解质,0.1mol/L氨水的pH=13,现在其pH=11,说明氨水是弱电解质,铵根离子能够水解,据此分析.
解答 解:A、如果是强电解质,0.1mol/L氨水的pH=13,现在其pH=11,说明氨水是弱电解质,氨水显弱碱性,故A正确;
B、氨水加水稀释,其碱性减弱,氢离子浓度增大,所以c(H+)/c(OH-) 的值增大,故B错误;
C、pH=11的NaOH和氨水中,氢氧根离子浓度相同,据电荷守恒,c(Na+)与氨水中c(NH4+)相同,故C错误;
D、铵根离子能够水解,所以NH4Cl 溶液中水的电离平衡:H2O?H++OH-向右移动,故D正确;
故选AD.
点评 本题考查了弱电解质的电离和盐的水解,明确弱电解质电离特点是解本题关键,注意电荷守恒在解题中的应用,题目难度不大.

练习册系列答案
相关题目
9.有一环状化合物C8H8它能使含溴的CCl4溶液褪色.也能使酸性高锰酸钾溶液褪色,并且它的分子中碳上的一个氢原子被氯取代后的衍生物只有一种,这种环状物可能是( )
| A. |  | B. | 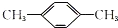 | C. | 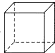 (立方烷) (立方烷) | D. | 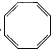 (环辛四烯) (环辛四烯) |
16.某未知溶液可能含Cl-、CO32-、Na+、SO42-、Al3+.将溶液滴在蓝色石蕊试纸上,试纸变红.取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀.下列判断合理的是( )
| A. | 可能有Cl-和SO42- | B. | 一定有Al3+ 和SO42- | ||
| C. | 可能有Al3+ 和Cl- | D. | 一定没有CO32- |
10.关于下列装置的说法正确的是( )
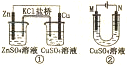

| A. | 装置中盐桥内的K+移向CuSO4溶液 | |
| B. | ①是将电能转变为化学能的装置 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置用于电解精炼钢,溶液中Cu2+的浓度保持不变 |
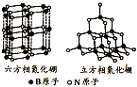 (1)短周期的元素a、b、c、d,原子序数依次增大.a原子的核外电子总数与其电子层数相同,b的基态原子各能级上排布的电子数相同,c的基态原子最高能层有3个未成对电子,d原子的最外层电子数为其内层电子数的3倍.
(1)短周期的元素a、b、c、d,原子序数依次增大.a原子的核外电子总数与其电子层数相同,b的基态原子各能级上排布的电子数相同,c的基态原子最高能层有3个未成对电子,d原子的最外层电子数为其内层电子数的3倍.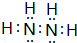 (填电子式).
(填电子式).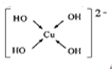 ;
;