题目内容
13.m mol乙炔跟n mol氢气在密闭容器中反应,当其达到平衡时,生成p mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )| A. | (3m+n)mol | B. | ($\frac{5}{2}m+\frac{n}{2}•3p$)mol | C. | (3m+n+2p)mol | D. | ($\frac{5}{2}m+\frac{n}{2}$)mol |
分析 据元素守恒,反应后混合气体的耗氧量即是m molC2H2和nmolH2的耗氧量,反应生成CO2和H2O,根据碳元素守恒有n(CO2)=2n(C2H2),根据氢元素守恒由n(H2O)=n(C2H2)+n(H2),根据氧元素守恒有2n(O2)=2n(CO2)+n(H2O),据此计算消耗的氧气.
解答 解:反应前后C和H反应后元素的质量没有发生变化,则混合气体的耗氧量即是m molC2H4和nmolH2的耗氧量,
根据碳元素守恒可知:n(CO2)=2n(C2H2)=2m mol,
根据氢元素守恒可知:n(H2O)=n(C2H2)+n(H2)=m mol+n mol,
根据氧元素守恒有2n(O2)=2n(CO2)+n(H2O)=2×2m mol+mmol+n mol=5m mol+nmol,
即n(O2)=$\frac{1}{2}$(5m+n)mol,
故选D.
点评 本题考查混合物的计算,题目难度中等,判断反应后混合气体的耗氧量与C2H2和H2的混合物的耗氧量相等为解答关键,注意掌握元素守恒在化学计算中的应用方法.

练习册系列答案
相关题目
4.下列说法错误的是( )
| A. | 有机物CH2=CH-CH3中碳的杂化类型有sp3 和sp2,其中有两个π键,7个σ键 | |
| B. | 分子CO和N2的原子总数相同,价电子总数相等 | |
| C. | Na+的电子排布式为1s22s22p6 | |
| D. | CO2分子的构型为直线型 |
8.等温等压下,关于等质量H2、D2、T2三种气体的下列叙述中正确的是( )
| A. | 密度之比1:2:3 | B. | 质子数之比6:3:2 | C. | 中子数之比0:3:4 | D. | 体积之比6:3:2 |
18.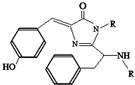 美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )
美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )
 美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )
美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )| A. | 该有机物属于芳香烃 | |
| B. | 该有机物能发生水解反应,且1mol该有机物需消耗氢氧化钠2mol | |
| C. | 该有机物能与溴水发生取代反应消耗Br2 3mol | |
| D. | 该有机物既能与盐酸反应,又能与碳酸氢钠溶液反应 |
5.下列实验合理的是( )
| A. | 用HNO3除去铜粉中混杂的Zn | |
| B. | 通入足量Cl2,除去Fe2(SO4)3溶液中的FeSO4 | |
| C. | 依次通过溴水和碱石灰,除去CH4中的乙烯 | |
| D. | 通过饱和Na2CO3溶液,除去CO2中混杂的SO2 |
2.A、B、C、D、E是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表:
(1)E元素基态原子的电子排布式是1s22s22p63s23p63d64s2;
(2)比较B与O元素的第一电离能:B>O,A与C的电负性:A<C (填<,=或>);A D形成的一种常见化合物,常温下为液体,是良好的有机溶剂,其分子中含有的共价键类型是σ键.(填“σ键”或“π键”).
(3)写出工业上制备D单质的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;
(4)E单质在海水中易发生电化学腐蚀,写出正极的电极反应式O2+2H2O+4e-=4OH-;
(5)在一定条件下,B与D可形成一种化合物,该化合物分子中每个原子最外层均为8电子,常温下为淡黄色液体,遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,写出该化合物与水反应的化学方程式:NCl3+3H2O═NH3+3HClO.
(6)己知单质B生成4.25g气态氢化物W时,释放出11.55KJ的热量.写出该反应的热化学方程式N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol.
| 元素 | 结构或性质信息 |
| A | 其原子最外层电子数是内层电子数的2倍 |
| B | 基态原子最外层电子排布为nSnnPn+1 |
| C | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| D | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的P电子 |
| E | 其与A形成的合金为目的用量最多的金属材料 |
(2)比较B与O元素的第一电离能:B>O,A与C的电负性:A<C (填<,=或>);A D形成的一种常见化合物,常温下为液体,是良好的有机溶剂,其分子中含有的共价键类型是σ键.(填“σ键”或“π键”).
(3)写出工业上制备D单质的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;
(4)E单质在海水中易发生电化学腐蚀,写出正极的电极反应式O2+2H2O+4e-=4OH-;
(5)在一定条件下,B与D可形成一种化合物,该化合物分子中每个原子最外层均为8电子,常温下为淡黄色液体,遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,写出该化合物与水反应的化学方程式:NCl3+3H2O═NH3+3HClO.
(6)己知单质B生成4.25g气态氢化物W时,释放出11.55KJ的热量.写出该反应的热化学方程式N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol.
3.下列分子或离子中不能跟质子(H+)结合的是( )
| A. | NH3 | B. | H2O | C. | HF | D. | CH4 |


 ;D的核磁共振氢谱共有3组峰.
;D的核磁共振氢谱共有3组峰.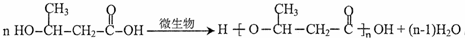 .
.
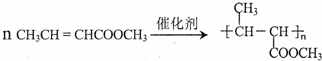 .
.