题目内容
15.X、Y、Z三种短周期元素的原子序数之和为28,X、Y为相邻周期元素,X、Z为同周期元素,Y的质子数比X多5个,X的最外层电子数是Y的2倍,X和Z的最外层电子数之和为11.下列叙述中不正确的是( )| A. | 元素Z的气态氢化物和最高价氧化物的水化物水溶液均呈酸性 | |
| B. | X、Y、Z三种元素组成的化合物,其化学式为Y(ZX3)3 | |
| C. | 元素Z可组成由共价键构成的单质 | |
| D. | X、Y两种元素构成一种阴离子,该阴离子与酸反应时,可能变成Y的阳离子 |
分析 短周期元素中,X、Y为相邻周期元素,Y的质子数比X多5个,X的最外层电子数是Y的2倍,由于X为H元素时,Y的原子序数为6,而最外层电子数为2,不符合题意,则X处于第二周期、Y处于第三周期,设Y最外层电子数为a,则X最外层电子数为2a,故2+8+a=2+2a+5,解得a=3,故X为O元素,Y为Al,三种元素的原子序数之和为28,故Z的原子序数为28-8-13=7,故Z为N元素,O元素与N原子同周期且最外层电子数之和为11,符合题意,据此解答.
解答 解:短周期元素中,X、Y为相邻周期元素,Y的质子数比X多5个,X的最外层电子数是Y的2倍,由于X为H元素时,Y的原子序数为6,而最外层电子数为2,不符合题意,则X处于第二周期、Y处于第三周期,设Y最外层电子数为a,则X最外层电子数为2a,故2+8+a=2+2a+5,解得a=3,故X为O元素,Y为Al,三种元素的原子序数之和为28,故Z的原子序数为28-8-13=7,故Z为N元素,O元素与N原子同周期且最外层电子数之和为11,符合题意.
A.元素Z的气态氢化物氨气、最高价氧化物的水化物为硝酸,硝酸水溶液呈酸性,但氨气水溶液呈碱性,故A错误;
B.X、Y、Z三种元素组成的化合物,其化学式为Al(NO3)3,故B正确;
C.元素Z单质为N2,氮原子之间为共价键,故C正确;
D.X、Y两种元素构成的AlO2-与酸反应时,可能变成Al3+,故D正确,
故选A.
点评 本题考查原子结构与元素性质,推断元素是解题关键,较好的考查学生分析推理能力,难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
6.“神舟七号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池.该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾.已知该电池的总反应为2H2+O2═2H2O,负极反应为H2+CO${\;}_{3}^{2-}$→CO2↑+H2O+2e-,则下列推断中,正确的是( )
| A. | 通氧气的电极为阳极,发生氧化反应 | |
| B. | 电池放电时,外电路电子由通氧气的正极流向通氢气的负极 | |
| C. | 正极的电极反应为:4OH-→O2↑+2H2O+2e- | |
| D. | 电池工作时,CO${\;}_{3}^{2-}$向负极移动 |
3.有机物CH3CH2C(CH3)2CH(C2H5)CH3的准确命名是( )
| A. | 3,4-二甲基-4-己基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,4,4-三甲基己烷 | D. | 2,3,3-三甲基己烷 |
20.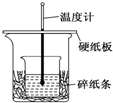 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )| A. | 如图条件下实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高 |
3.某元素原子的最外层上的电子数是次外层上的电子数的a倍(a>1),则该元素原子核内的质子数为( )
| A. | 2a | B. | 2a+2 | C. | 2a+10 | D. | a+2 |
4.化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| B. | 石油干馏可得到石油气、汽油、煤油、柴油等 | |
| C. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| D. | 制作快餐盒的聚苯乙烯塑料是易降解塑料 |
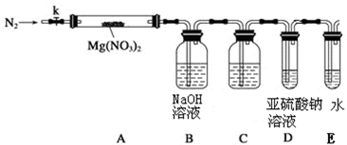 某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.