题目内容
20.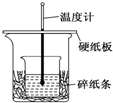 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )| A. | 如图条件下实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高 |
分析 A.根据实验过程的保温情况确定保温效果;
B.根据量热计的构造来判断该装置的缺少仪器;
C.根据烧杯间填满碎纸条的作用是保温;
D.中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关.
解答 解:A.该装置的保温效果并不如量热计那样好,大小烧杯之间要填满纸片,装置存在热量的散失,故A错误;
B.根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故B正确;
C.中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故C错误;
D.中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关,中和热数值相等,故D错误;
故选B.
点评 本题考查中和热的测定,题目难度不大,注意理解中和热的概念是解题的关键.

练习册系列答案
相关题目
10.往100mL氢离子浓度为1mol•L-1的硫酸和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况).则反应前的混合液中含硫酸的物质的量为( )
| A. | 0.01mol | B. | 0.02 mol | C. | 0.03 mol | D. | 0.04 mol |
11.下列各组离子在给定条件下一定能大量共存的是( )
| A. | 使pH试纸显蓝色的溶液中:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 含有大量NO${\;}_{3}^{-}$的溶液中:NH${\;}_{4}^{+}$、I-、SO42-、H+ | |
| C. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO${\;}_{3}^{-}$、Mg2+ | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、[AI(OH)4]、K+ |
15.X、Y、Z三种短周期元素的原子序数之和为28,X、Y为相邻周期元素,X、Z为同周期元素,Y的质子数比X多5个,X的最外层电子数是Y的2倍,X和Z的最外层电子数之和为11.下列叙述中不正确的是( )
| A. | 元素Z的气态氢化物和最高价氧化物的水化物水溶液均呈酸性 | |
| B. | X、Y、Z三种元素组成的化合物,其化学式为Y(ZX3)3 | |
| C. | 元素Z可组成由共价键构成的单质 | |
| D. | X、Y两种元素构成一种阴离子,该阴离子与酸反应时,可能变成Y的阳离子 |
9.某反应方程式为 ,下列说法错误的是( )
,下列说法错误的是( )
 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 反应物的分子式为C10H10O4 | |
| B. | X的结构简式为CH3OH | |
| C. | 生成物中带“※”号的C原子来自“ ”中的甲基 ”中的甲基 | |
| D. | 反应物和生成物具有相同的不饱和度 |

 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应. ,反应③的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,反应③的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.