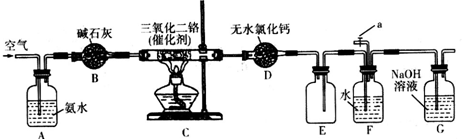
题目内容
3.某元素原子的最外层上的电子数是次外层上的电子数的a倍(a>1),则该元素原子核内的质子数为( )| A. | 2a | B. | 2a+2 | C. | 2a+10 | D. | a+2 |
分析 最外层电子数不超过8,主族元素的原子的最外层电子数是次外层的a倍(a>1),该元素原子有2个电子层,最外层电子数为2a.据此判断.
解答 解:最外层电子数不超过8,主族元素的原子的最外层电子数是次外层的a倍(a>1),则该元素原子有2个电子层,最外层电子数为2a,所以该元素原子核外电子数为2a+2,对于电中性原子,质子数=核外电子数,所以该原子核内质子数为2a+2.
故选:B.
点评 本题考查核外电子排布规律,比较基础,判断元素原子有2个电子层是关键,掌握核外电子排布规律并能灵活运用.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
14.下列反应的离子方程式中,不正确的是( )
| A. | 用碳棒作电极电解硫酸铜溶液:2Cu2++2H2O═2Cu+O2↑+4H+ | |
| B. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| C. | Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| D. | 苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O$\stackrel{通电}{→}$C6H5OH+HCO${\;}_{3}^{-}$ |
15.X、Y、Z三种短周期元素的原子序数之和为28,X、Y为相邻周期元素,X、Z为同周期元素,Y的质子数比X多5个,X的最外层电子数是Y的2倍,X和Z的最外层电子数之和为11.下列叙述中不正确的是( )
| A. | 元素Z的气态氢化物和最高价氧化物的水化物水溶液均呈酸性 | |
| B. | X、Y、Z三种元素组成的化合物,其化学式为Y(ZX3)3 | |
| C. | 元素Z可组成由共价键构成的单质 | |
| D. | X、Y两种元素构成一种阴离子,该阴离子与酸反应时,可能变成Y的阳离子 |
18.实验室可用下列方法制取气体,其中必须用排水法的是( )
| A. | 铜片与稀硝酸共热 | B. | 二氧化锰与盐酸共热 | ||
| C. | 锌与稀硫酸共热 | D. | 稀盐酸与碳酸钙的反应 |
13.下列事实能够证明Al2O3中一定存在离子键的是( )
| A. | 水溶液能导电 | B. | 有较高的熔点 | C. | 熔化时能导电 | D. | 易溶于水 |

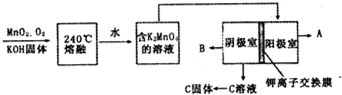
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.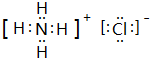 ,反应③的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,反应③的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.