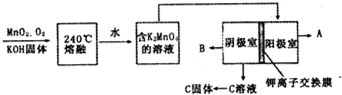
题目内容
6.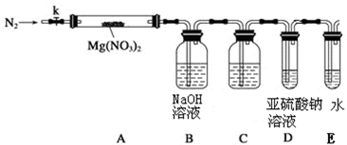 某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.【提出猜想】小组提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2 乙:MgO、NO2、O2
丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)查阅资料得知,NO2可被NaOH溶液吸收,反应的化学方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.
(2)实验前,小组成员经讨论认定猜想丁不成立,理由是不符合氧化还原反应原理.
【实验操作】
(3)设计上述装置,用氮气排尽装置中空气,其目的是避免对产物O2的检验产生干扰;加热Mg(NO3)2固体,AB装置实验现象是:固体减少,说明有Mg(NO3)2固体分解了产生红棕色气体,溶液中有气泡冒出,有NO2生成.
(4)有同学提出可用亚硫酸钠溶液检验是否有氧气产生,但通入之前,还需在BD装置间增加滴有酚酞的氢氧化钠溶液,其作用是:确保二氧化氮已被除尽,防止干扰氧气的检验
(5)小组讨论后认为即便通过C后有氧气,仅仅用亚硫酸钠溶液仍然难以检验,因为:亚硫酸钠溶液与氧气反应没有明显现象,难以判断反应是否发生了,改进的措施是可在亚硫酸钠溶液中加入几滴酚酞试剂.
(6)上述系列改进后,如果分解产物中有O2存在,排除装置与操作的原因,未检测到的原因是4NO2+O2+2H2O=4HNO3或4NO2+O2+4NaOH=4NaNO3+2H2O.(用化学方程式表示)
分析 (1)NO2在碱性条件下自身发生氧化还原反应,与氢氧化钠反应生成NaNO3和NaNO2;
(2)根据氧化还原反应化合价升降相等判断;
(3)为检验是否生成氧气,应将装置内的氧气排尽;加热Mg(NO3)2固体,固体质量减小,如生成红棕色气体,则有NO2生成;
(4)亚硫酸钠具有还原性,可被氧气氧化,也可被二氧化氮氧化;
(5)亚硫酸钠溶液与氧气反应没有明显现象,结合亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性判断;
(6)如果分解产物中有O2存在,但没有检测到,可能原因是二氧化氮、氧气与水反应.
解答 解:(1)NO2在碱性条件下自身发生氧化还原反应,与氢氧化钠反应生成NaNO3和NaNO2,反应的方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O,
故答案为:2NO2+2NaOH=NaNO3+NaNO2+H2O;
(2)由于丙产物中化合价只有降低情况,没有升高,不满足氧化还原反应的特征,故答案为:不符合氧化还原反应原理;
(3)为检验是否生成氧气,应将装置内的氧气排尽,避免对产物O2的检验产生干扰,加热Mg(NO3)2固体,固体质量减小,如生成红棕色气体,则有NO2生成,
故答案为:避免对产物O2的检验产生干扰(或其它合理答案);固体减少;产生红棕色气体,溶液中有气泡冒出;
(4)亚硫酸钠具有还原性,可被氧气氧化,也可被二氧化氮氧化,通入之前,还需在BD装置间增加滴有酚酞的氢氧化钠溶液,可确保二氧化氮已被除尽,防止干扰氧气的检验,
故答案为:确保二氧化氮已被除尽,防止干扰氧气的检验;
(5)亚硫酸钠溶液与氧气反应没有明显现象,结合亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性判断,可滴加几滴酚酞试剂,如溶液由红色变为无色,说明有氧气生成,
故答案为:亚硫酸钠溶液与氧气反应没有明显现象,难以判断反应是否发生了;几滴酚酞试剂;
(6)如果分解产物中有O2存在,但没有检测到,可能原因是二氧化氮、氧气与水反应,发生方程式为4NO2+O2+2H2O=4HNO3 或4NO2+O2+4NaOH=4NaNO3+2H2O,
故答案为:4NO2+O2+2H2O=4HNO3 或4NO2+O2+4NaOH=4NaNO3+2H2O.
点评 本题为实验探究题目,侧重于学生的分析、实验能力的考查,为高考常见题型,答题时主要在把握物质的性质基础上把握实验的原理、目的以及相关实验的基本操作,题目难度不大,但需夯实基础.

 名校课堂系列答案
名校课堂系列答案X$\stackrel{O_{2}}{→}$酸性氧化物→还原性盐.
| A. | X可能是Si单质 | B. | X可能是含S元素的化合物 | ||
| C. | 酸性氧化物可能为CO2 | D. | 还原性盐可能为FeCl3 |
| A. | 元素Z的气态氢化物和最高价氧化物的水化物水溶液均呈酸性 | |
| B. | X、Y、Z三种元素组成的化合物,其化学式为Y(ZX3)3 | |
| C. | 元素Z可组成由共价键构成的单质 | |
| D. | X、Y两种元素构成一种阴离子,该阴离子与酸反应时,可能变成Y的阳离子 |
| A. | 铜片与稀硝酸共热 | B. | 二氧化锰与盐酸共热 | ||
| C. | 锌与稀硫酸共热 | D. | 稀盐酸与碳酸钙的反应 |
| A. | 离子化合物中可能含共价键 | B. | 碱和铵盐都是离子化合物 | ||
| C. | 离子化合物中不一定含金属元素 | D. | 离子化合物中一定含离子键 |
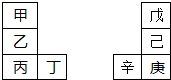 甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,
甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素, ,写出一种含戊、己两种元素的离子化合物的化学式(NH4)3PO4或(NH4)2HPO4、NH4H2PO4.
,写出一种含戊、己两种元素的离子化合物的化学式(NH4)3PO4或(NH4)2HPO4、NH4H2PO4.