题目内容
8.下列依据热化学方程式得出的结论正确的是( )| A. | 已知2H2(g)+O2(g)═2H2O(g),△H=-483.6kJ,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知OH-(aq)+H+(aq)═H2O(l)△H=-57.3kJ•mol-1,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)═2CO(g),△H=b,则a>b | |
| D. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧生成液态水;
B、醋酸是弱酸,没有完全电离;
C、2mol碳单质,完全燃烧时放出热量更多,反应是放热反应焓变为负值;
D、物质能量越高越活泼.
解答 解:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧生成液态水,由热化学方程式可知,氢气的燃烧热<-241.8kJ•mol-1,故A错误;
B、醋酸是弱酸,没有完全电离,措施电离吸热,所以1molNaOH与醋酸中和放热小于57.3 kJ,故B错误;
C、2mol碳单质,完全燃烧时放出热量更多,焓变为负值,则a<b,故C错误;
D、已知C(石墨,s)═C(金刚石,s)△H>0,钙反应为吸热反应,金刚石能量高,则石墨比金刚石稳定,故D正确;
故选D.
点评 本题考查了反应热的大小比较、弱酸的中和热、物质的能量越低越稳定、热化学方程式的书写,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.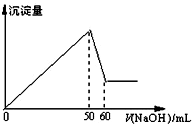 在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度
在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度
之比为( )
 在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度
在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度之比为( )
| A. | 1:1 | B. | 3:1 | C. | 1:2 | D. | 2:1 |
13.a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示.
请回答:
(1)基态c原子核外存在4对自旋相反的电子,其基态原子的价电子排布图为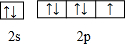 .
.
(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)a元素最高价氧化物对应水化物的酸根离子的空间构型为平面三角形,中心原子的轨道杂化类型为sp3杂化.
(4)c的氢化化极易溶于水,除因为与水分子之间易形成氢键处,还因为氨气与水分子都是极性分子,相似相溶.
(5)d可形成面心立方最密堆积的晶体,若d的相对分子质量为M,密度为ag•cm-3,则d晶胞的体积为$\frac{4M}{{aN}_{A}}$cm3(用M、a表示,阿伏加德罗常数的值用NA表示).
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 基态原子M层全充满,N层只有一个电子 |
(1)基态c原子核外存在4对自旋相反的电子,其基态原子的价电子排布图为
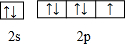 .
.(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)a元素最高价氧化物对应水化物的酸根离子的空间构型为平面三角形,中心原子的轨道杂化类型为sp3杂化.
(4)c的氢化化极易溶于水,除因为与水分子之间易形成氢键处,还因为氨气与水分子都是极性分子,相似相溶.
(5)d可形成面心立方最密堆积的晶体,若d的相对分子质量为M,密度为ag•cm-3,则d晶胞的体积为$\frac{4M}{{aN}_{A}}$cm3(用M、a表示,阿伏加德罗常数的值用NA表示).
20.原电池的构造如图所示,下列说法不正确的是( )
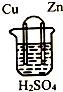

| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由铜片流向锌片 | |
| D. | 该电池工作时,H+在铜片上得电子被还原生成H2逸出 |
17.用激光笔照射下列分散系,能观察到丁达尔效应的是( )
| A. | NaCl水溶液 | B. | NaCl与酒精形成的胶体 | ||
| C. | 黄色的FeCl3溶液 | D. | 无色透明的CCl4液体 |
18.乙醇和乙酸是生活中两种常见的有机物.下列说法正确的是( )
| A. | 乙醇、乙酸互为同分异构体 | |
| B. | 乙醇、乙酸都能与钠反应 | |
| C. | 乙醇、乙酸都能与NaOH溶液反应 | |
| D. | 乙醇、乙酸都能使紫色石蕊试液变红色 |
 氢氧燃料电池已用于航天飞机.以30% KOH溶液为电解质溶液的这种电池的构造如图所示.该电池在工作时的电极反应如下:
氢氧燃料电池已用于航天飞机.以30% KOH溶液为电解质溶液的这种电池的构造如图所示.该电池在工作时的电极反应如下: