题目内容
16.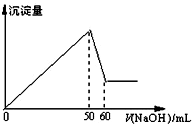 在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度
在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度之比为( )
| A. | 1:1 | B. | 3:1 | C. | 1:2 | D. | 2:1 |
分析 在AlCl3和MgCl2的混合溶液中滴加NaOH溶液,生成的沉淀逐渐增加,当沉淀达到最大量后,氢氧化铝沉淀开始溶解,设出氯化铝、氯化镁、NaOH的物质的量浓度,然后根据图象中数据列式计算即可.
解答 解:设氯化铝的物质的量浓度为x,氯化镁的浓度为y,氢氧化钠溶液的浓度为z,原混合液体积为VL,
溶解氢氧化铝的反应为:Al(OH)3+OH-═AlO2-+2H2O,总共消耗了60mL-50mL=10mLNaOH溶液,
则:xV=0.01×z,x=$\frac{0.01z}{V}$,
氯化铝、氯化镁转化成氢氧化铝、氢氧化镁沉淀消耗氢氧化钠的总体积为50mL,
则:3xV+2yV=0.05z,将x=$\frac{0.01z}{V}$带入可得:y=$\frac{0.01z}{V}$,
所以原混合液中AlCl3与MgCl2的物质的量浓度之比为x:y=$\frac{0.01z}{V}$:$\frac{0.01z}{V}$=1:1,
故选A.
点评 本题考查了混合物反应的计算、物质的量浓度的计算,题目难度中等,明确图象中曲线变化的含义为解答关键,注意掌握混合物反应计算的方法与技巧,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
10.下列实验操作和现象,结论或目的均正确的是( )
| 选项 | 操作和现象 | 结论或目的 |
| A | 向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液呈红色 | 红砖中含有氧化铁 |
| B | CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液,溶液不显红色 | 黑色固体中没有Fe3O4 |
| C | 取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 向某溶液中通入Cl2,然后再加入KSCN溶液变红色 | 原溶液中含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
7.实验室用NaOH固体配制480mL0.2mol•L-1的NaOH溶液.清回答下列问题:
(l)配制480mL0.2mol•L-1的NaOH溶液
(2)容量瓶|4.需标有以下五项中的①③⑤,
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E、D;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面与刻度线相切.
F.继续往容量瓶内小心加水,眼睛注视液面,直到液面接近刻度1~2cm处
(4)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有ABC(填序号).
A.在烧杯中稀释溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.容量瓶刚用蒸馏水洗净,没有烘干.
(l)配制480mL0.2mol•L-1的NaOH溶液
| 应称取的质量NaOH/g | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它玻璃仪器 |
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E、D;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面与刻度线相切.
F.继续往容量瓶内小心加水,眼睛注视液面,直到液面接近刻度1~2cm处
(4)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有ABC(填序号).
A.在烧杯中稀释溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.容量瓶刚用蒸馏水洗净,没有烘干.
4. 氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
①N2 (g)+3H2 (g)?2NH3 (g)△H1
②4NH3(g)+5O2 (g)═4NO(g)+6H2O(l)△H2
③N2 (g)+O2 (g)═2NO (g)△H
能否应用△H1和△H2表示△H?若能用△H1和△H2表示△H,则写出△H=无;若不能,说明理由:不能,缺少氢气的燃烧热.
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
下列说法正确的是②③(填序号)
①反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
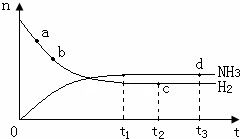
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0.氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如图:
正反应速率最大的点是a(选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是cd(选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线.
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳.实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)△H<0
两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
容器I中的反应是(选填“是”或“否”)达到平衡状态,该反应在温度为T时的平衡常数K=1.0.表格内的空格处v(正)与v(逆)的大小关系是v(正)<v(逆).
 氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
①N2 (g)+3H2 (g)?2NH3 (g)△H1
②4NH3(g)+5O2 (g)═4NO(g)+6H2O(l)△H2
③N2 (g)+O2 (g)═2NO (g)△H
能否应用△H1和△H2表示△H?若能用△H1和△H2表示△H,则写出△H=无;若不能,说明理由:不能,缺少氢气的燃烧热.
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
①反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0.氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如图:
正反应速率最大的点是a(选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是cd(选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线.
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳.实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)△H<0
两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
| 容器 | c(CO2) /mol•L-1 | c(H2) /mol•L-1 | c(CH3OCH3) /mol•L-1 | c(H2O) /mol•L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
11.2014年5月7日,天津某公司在南京丢失一枚放射源:铱-192( ${\;}_{77}^{192}$Ir),环保部定性为重大辐射事故.下列有关${\;}_{77}^{192}$Ir的说法中正确的是( )
| A. | ${\;}_{77}^{192}$Ir原子核内含有192个质子 | |
| B. | ${\;}_{77}^{192}$Ir 和${\;}_{77}^{191}$Ir互为同位素 | |
| C. | ${\;}_{77}^{192}$Ir原子核内含有77个中子 | |
| D. | ${\;}_{77}^{192}$Ir的电子数为115 |
1.下列分子具有正四面体结构的是( )
| A. | CH4 | B. | CH3Cl | C. | C2H6 | D. | C2H4 |
8.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g),△H=-483.6kJ,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知OH-(aq)+H+(aq)═H2O(l)△H=-57.3kJ•mol-1,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)═2CO(g),△H=b,则a>b | |
| D. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |
6.将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
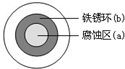

| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-→4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-→Cu2+ |