题目内容
19.已知25℃时,CH3COOH和NH3•H2O的电离平衡常数分别为Ka(CH3COOH)=l.7×10-5mol/L,Kb(NH3•H2O)=1.7×l0-5mol/L.现有常温下1mol/L的醋酸溶液和l mol/L的氨水,且知醋酸溶液的pH=a,试回答下列问题:(1)醋酸溶液中存在的电离平衡用电离方程式表示为CH3COOH?CH3COO-+H+,
(2)将上述两种溶液等体积混合,所得溶液的pH=7.
(3)饱和氯化铵溶液显酸性,原因是(用离子方程式表示)NH4++H2O?NH3•H2O+H+;向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解.甲、乙两位同学分别提出了不同的解释:
甲同学:由于NH4+水解呈酸性,其H+结合Mg(OH)2电离的OH-,使Mg(OH)2溶解
乙同学:由于Mg(OH)2?Mg2++2OH-,NH4++OH-?NH3•H2O,使Mg(OH)2溶解.请你设计一个实验验证两位同学的解释往氢氧化镁悬浊液中加入是量醋酸铵溶液,若固体溶解,则乙解释合理,若不溶解,则甲解释合理.
分析 (1)醋酸是弱电解质,在水溶液里部分电离生成醋酸根离子和氢离子;
(2)醋酸和一水合氨的电离平衡常数相等,则醋酸根离子和铵根离子水解程度相等,等体积等浓度的氨水和醋酸恰好完全反应生成醋酸铵,溶液呈中性;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性;
为了证明Mg(OH)2悬浊液与氯化铵溶液的反应原理,可加入醋酸铵溶液检验,因醋酸铵溶液呈中性,如甲同学的解释正确,则氢氧化镁不溶解,如氢氧化镁溶解,则乙同学的解释正确.
解答 解:(1)醋酸是弱电解质,在水溶液里部分电离生成醋酸根离子和氢离子,电离方程式为:CH3COOH?CH3COO-+H+,故答案为:CH3COOH?CH3COO-+H+;
(2)醋酸和一水合氨的电离平衡常数相等,则醋酸根离子和铵根离子水解程度相等,等体积等浓度的氨水和醋酸恰好完全反应生成醋酸铵,由于醋酸根离子和铵根离子水解程度相等,所以溶液呈中性,pH=7,故答案为:7;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,水解离子方程式为NH4++H2O?NH3•H2O+H+,其检验方法为:往氢氧化镁悬浊液中加入是量醋酸铵溶液,若固体溶解,则乙解释合理,若不溶解,则甲解释合理,
故答案为:NH4++H2O?NH3•H2O+H+;往氢氧化镁悬浊液中加入是量醋酸铵溶液,若固体溶解,则乙解释合理,若不溶解,则甲解释合理.
点评 本题以弱电解质的电离及盐类水解为载体考查了性质实验方案设计,根据物质的性质设计实验,同时考查学生实验探究、操作能力和分析能力,难度中等.

练习册系列答案
相关题目
13.2011年,日本发生大地震并引起福岛第一核电站事故,在这国内地大部分地区空气中监测到来自日本核事故释放出的极微量人工放射性核素碘-131.有关$\underset{131}{53}$I叙述不正确的是( )
| A. | 131是这种碘-131的质量数 | B. | $\underset{131}{53}$I与$\underset{127}{53}$I互为同位素 | ||
| C. | 碘-131的中子数为53 | D. | 碘元素在周期表中位于第ⅦA族 |
14.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol Na2O2固体中含有O22- 2NA | |
| B. | 常温常压下,3.2g CH4中含有电子2NA | |
| C. | 标准状况下,11.2L CH3CH2OH中含有分子0.5NA | |
| D. | 100mL 1mol•L-1的CH3COOH溶液中含有CH3COOH分子0.1NA |
7.实验室用NaOH固体配制480mL0.2mol•L-1的NaOH溶液.清回答下列问题:
(l)配制480mL0.2mol•L-1的NaOH溶液
(2)容量瓶|4.需标有以下五项中的①③⑤,
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E、D;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面与刻度线相切.
F.继续往容量瓶内小心加水,眼睛注视液面,直到液面接近刻度1~2cm处
(4)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有ABC(填序号).
A.在烧杯中稀释溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.容量瓶刚用蒸馏水洗净,没有烘干.
(l)配制480mL0.2mol•L-1的NaOH溶液
| 应称取的质量NaOH/g | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它玻璃仪器 |
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E、D;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面与刻度线相切.
F.继续往容量瓶内小心加水,眼睛注视液面,直到液面接近刻度1~2cm处
(4)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有ABC(填序号).
A.在烧杯中稀释溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.容量瓶刚用蒸馏水洗净,没有烘干.
14.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 10g重水(2H216O)中含有的中子数目为5NA | |
| B. | 28g氮气所含有的原子数目为NA | |
| C. | 标准状况下,2.24L水中含有的水分子数目为0.1NA | |
| D. | 1mol铁与足量稀盐酸反应转移的电子数目为3NA |
4.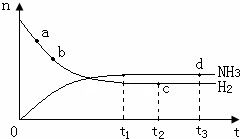 氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
①N2 (g)+3H2 (g)?2NH3 (g)△H1
②4NH3(g)+5O2 (g)═4NO(g)+6H2O(l)△H2
③N2 (g)+O2 (g)═2NO (g)△H
能否应用△H1和△H2表示△H?若能用△H1和△H2表示△H,则写出△H=无;若不能,说明理由:不能,缺少氢气的燃烧热.
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
下列说法正确的是②③(填序号)
①反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0.氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如图:
正反应速率最大的点是a(选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是cd(选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线.
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳.实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)△H<0
两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
容器I中的反应是(选填“是”或“否”)达到平衡状态,该反应在温度为T时的平衡常数K=1.0.表格内的空格处v(正)与v(逆)的大小关系是v(正)<v(逆).
 氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
①N2 (g)+3H2 (g)?2NH3 (g)△H1
②4NH3(g)+5O2 (g)═4NO(g)+6H2O(l)△H2
③N2 (g)+O2 (g)═2NO (g)△H
能否应用△H1和△H2表示△H?若能用△H1和△H2表示△H,则写出△H=无;若不能,说明理由:不能,缺少氢气的燃烧热.
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
①反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0.氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如图:
正反应速率最大的点是a(选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是cd(选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线.
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳.实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)△H<0
两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
| 容器 | c(CO2) /mol•L-1 | c(H2) /mol•L-1 | c(CH3OCH3) /mol•L-1 | c(H2O) /mol•L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
11.2014年5月7日,天津某公司在南京丢失一枚放射源:铱-192( ${\;}_{77}^{192}$Ir),环保部定性为重大辐射事故.下列有关${\;}_{77}^{192}$Ir的说法中正确的是( )
| A. | ${\;}_{77}^{192}$Ir原子核内含有192个质子 | |
| B. | ${\;}_{77}^{192}$Ir 和${\;}_{77}^{191}$Ir互为同位素 | |
| C. | ${\;}_{77}^{192}$Ir原子核内含有77个中子 | |
| D. | ${\;}_{77}^{192}$Ir的电子数为115 |
8.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g),△H=-483.6kJ,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知OH-(aq)+H+(aq)═H2O(l)△H=-57.3kJ•mol-1,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)═2CO(g),△H=b,则a>b | |
| D. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |
9.在元素周期表中,同主族元素原子具有相同的( )
| A. | 电子层数 | B. | 核外电子数 | C. | 最外层电子数 | D. | 核电荷数 |