题目内容
2.将13.7gNa2CO3和NaHCO3 的混合物,充分加热一段时间后,质量变为10.6g,求原混合物中Na2CO3 和NaHCO3 的物质的量.分析 加热时NaHCO3分解,固体质量的变化是NaHCO3分解的缘故,可结合方程式用差量法计算,来原混合物中Na2CO3 和NaHCO3 的质量,从而求出各物质的物质的量.
解答 解:设混合物中含有xmolNaHCO3,
2NaHCO3Na2CO3+CO2↑+H2O△m
2mol 62g
xmol 13.7g-10.6g=3.1g
所以,解之得x=0.1mol,所以n(Na2CO3)==0.05mol,
答:混合物中Na2CO3 和NaHCO3 的物质的量分别为0.05mol、0.1mol.
点评 本题考查混合物的计算,题目难度不大,注意差量法的运用.

练习册系列答案
相关题目
12.下图所示的实验,不能达到实验目的是(各选项中对比溶液的浓度体积均相同)( )
| 实验方案 | 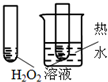 | 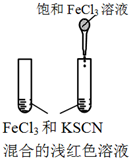 | 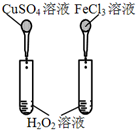 | 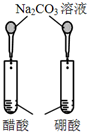 |
| 目的 | A.验证升高温度可加快H2O2分解 | B.验证增大反应物浓度对平衡的影响 | C.比较Cu2+、Fe3+对 H2O2分解速率的影响 | D.比较弱酸的 相对强弱 |
| A. | A | B. | B | C. | C | D. | D |
13.2011年,日本发生大地震并引起福岛第一核电站事故,在这国内地大部分地区空气中监测到来自日本核事故释放出的极微量人工放射性核素碘-131.有关I叙述不正确的是( )
| A. | 131是这种碘-131的质量数 | B. | I与I互为同位素 | ||
| C. | 碘-131的中子数为53 | D. | 碘元素在周期表中位于第ⅦA族 |
10.下列实验操作和现象,结论或目的均正确的是( )
| 选项 | 操作和现象 | 结论或目的 |
| A | 向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液呈红色 | 红砖中含有氧化铁 |
| B | CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液,溶液不显红色 | 黑色固体中没有Fe3O4 |
| C | 取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 向某溶液中通入Cl2,然后再加入KSCN溶液变红色 | 原溶液中含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
14.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol Na2O2固体中含有O22- 2NA | |
| B. | 常温常压下,3.2g CH4中含有电子2NA | |
| C. | 标准状况下,11.2L CH3CH2OH中含有分子0.5NA | |
| D. | 100mL 1mol•L-1的CH3COOH溶液中含有CH3COOH分子0.1NA |
7.实验室用NaOH固体配制480mL0.2mol•L-1的NaOH溶液.清回答下列问题:
(l)配制480mL0.2mol•L-1的NaOH溶液
(2)容量瓶|4.需标有以下五项中的①③⑤,
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E、D;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面与刻度线相切.
F.继续往容量瓶内小心加水,眼睛注视液面,直到液面接近刻度1~2cm处
(4)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有ABC(填序号).
A.在烧杯中稀释溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.容量瓶刚用蒸馏水洗净,没有烘干.
(l)配制480mL0.2mol•L-1的NaOH溶液
| 应称取的质量NaOH/g | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它玻璃仪器 |
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E、D;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面与刻度线相切.
F.继续往容量瓶内小心加水,眼睛注视液面,直到液面接近刻度1~2cm处
(4)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有ABC(填序号).
A.在烧杯中稀释溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.容量瓶刚用蒸馏水洗净,没有烘干.
8.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g),△H=-483.6kJ,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知OH-(aq)+H+(aq)═H2O(l)△H=-57.3kJ•mol-1,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)═2CO(g),△H=b,则a>b | |
| D. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |