题目内容
【题目】一定温度下,向10 mL 0.40 mol/L H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++ O2↑+ 2H+,② H2O2 + 2Fe2+ + 2H+
2Fe2++ O2↑+ 2H+,② H2O2 + 2Fe2+ + 2H+ ![]() 2Fe3++2H2O,
2Fe3++2H2O,
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
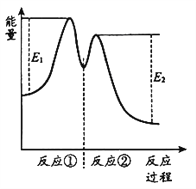
反应过程中能量变化如下图所示。
下列说法不正确的是
A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol/( L·min)
B. Fe3+的作用是增大过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq) ![]() 2H2O(l) + O2(g)的△H > 0
2H2O(l) + O2(g)的△H > 0
【答案】D
【解析】A. 0~6 min产生O2的物质的量为n(O2)=0.0224L÷22.4L/mol=0.001mol,则相同时间内消耗H2O2的物质的量为n(H2O2)=2n(O2)=0.002mol,所以在0~6 min的平均反应速率:v(H2O2) =0.002mol÷0.01L÷6min= 3.33×10-2 mol/( L·min),故A正确;B.由反应①、②可知Fe3+在反应中起催化作用,增大过氧化氢的分解速率,故B正确;C.由反应过程的能量变化示意图可知,反应①中反应物的总能量小于生成物的总能量,反应②中反应物的总能量大于生成物的总能量,所以反应①为吸热反应、反应②为放热反应,故C正确;D.据图可知,反应物H2O2(aq)的总能量大于生成物H2O(l)和O2(g)的总能量,则反应2H2O2(aq) ![]() 2H2O(l) + O2(g)为放热反应,△H<0,故D错误;答案选D。
2H2O(l) + O2(g)为放热反应,△H<0,故D错误;答案选D。

【题目】恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2) / mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
下列说法正确的是
A. 0~2 min内的平均速率为υ (CO)=0.6 mol/(L·min)
B. 4 min后,平衡移动的原因可能是再向容器中加入了2.0 mol的SO2
C. 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D. 若其他条件不变,起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol