题目内容
【题目】I.(1)0.2 g H2含有________个H原子。
(2)12.4克Na2X中含有0.4molNa+,则Na2X的摩尔质量是_________。
II.如图所示为实验室某浓盐酸试剂瓶上标签的有关内容。取该盐酸10mL,加蒸馏水稀释至250mL,向其中加入mg锌粉恰好完全反应。
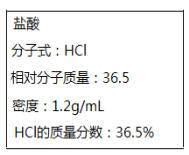
(1)求原浓盐酸的物质的量浓度c=____________。
(2)计算出m=___________。
(3)向反应后的溶液中加入0.6mol/L的AgNO3溶液至不再产生沉淀,共消耗VmL AgNO3溶液,则V的值是__________。
【答案】1.204×1023 62g/mol 12mol/L 3.9g 200
【解析】
I.(1)1个氢气分子中含2个H原子;
(2)12.4克Na2X中含有0.4molNa+,根据Na2X的组成计算出Na2X的物质的量及摩尔质量,根据摩尔质量与相对分子量的关系计算出X的相对原子质量;
II. (1)根据浓盐酸试剂瓶标签数据计算出物质的量浓度;
(2)根据锌和盐酸反应方程式计算反应消耗锌的质量;
(3)根据氯化锌和硝酸银溶液反应方程式计算消耗的AgNO3的物质的量,再根据V=![]() 计算 AgNO3溶液的体积。
计算 AgNO3溶液的体积。
I.(1)1个氢气分子中含2个H原子,n(H2)=![]() =0.1mol,n(H)=0.1mol×2=0.2mol,则H原子个数为0.2NA=1.204×1023,
=0.1mol,n(H)=0.1mol×2=0.2mol,则H原子个数为0.2NA=1.204×1023,
故答案为:1.204×1023;
(2)12.4克Na2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=![]() n(Na+)=0.4mol×
n(Na+)=0.4mol×![]() =0.2mol,Na2X的摩尔质量为:M(Na2X)=
=0.2mol,Na2X的摩尔质量为:M(Na2X)=![]() =62g/mol,
=62g/mol,
故答案为:62g/mol;
II.(1)1L该浓盐酸中含有的氯化氢的质量为:![]() mol=12mol,该盐酸的物质的量浓度为:12mol/L,
mol=12mol,该盐酸的物质的量浓度为:12mol/L,
故答案为:12mol/L;
(2)含有的氯化氢的物质的量为12mol/L×0.01L=0.12mol,消耗锌的物质的量为0.06mol,质量m=0.06mol×65g/mol=3.9g,
故答案为:3.9g;
(3)反应后,溶液中溶质氯化锌的物质的量为0.06mol,含Cl-0.12mol,则反应消耗 AgNO3为0.12mol,AgNO3溶液体积为V=![]() =
=![]() =0.2L=200mL,
=0.2L=200mL,
故答案为:200。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】一定温度下,向10 mL 0.40 mol/L H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++ O2↑+ 2H+,② H2O2 + 2Fe2+ + 2H+
2Fe2++ O2↑+ 2H+,② H2O2 + 2Fe2+ + 2H+ ![]() 2Fe3++2H2O,
2Fe3++2H2O,
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
反应过程中能量变化如下图所示。

下列说法不正确的是
A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol/( L·min)
B. Fe3+的作用是增大过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq) ![]() 2H2O(l) + O2(g)的△H > 0
2H2O(l) + O2(g)的△H > 0
【题目】14g铜金合金与足量的某浓度HNO3反应,将产生的气体用2.24L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为( )
A.9.6gB.6.4gC.12.8gD.1.6g

