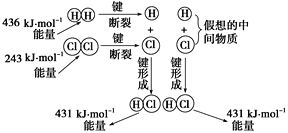
题目内容
【题目】将镁和铝的混合物0.1mol溶于100mL 2 mol/L的H2SO4溶液中,然后滴加1 mol/L的NaOH溶液。在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。请回答:
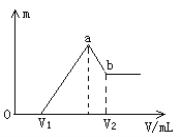
(1)写出0--V1段直线发生反应的离子方程式________________________________。
(2)a点的沉淀有______________________ 。
(3)若当V1=140mL时,则金属粉末中n(Mg)=______mol,V2=__________mL。
【答案】H++OH-=H2O Al(OH)3 Mg(OH)2 0.04mol 460mL
【解析】
将镁和铝的混合物0.1mol溶于100mL 2 mol/L的H2SO4溶液中生成硫酸镁、硫酸铝和氢气,根据图像可知开始阶段没有沉淀生成,说明硫酸过量,结合曲线的变化趋势和有关反应的分析解答。
(1)0-V1段直线没有产生沉淀,说明发生中和反应,反应的离子方程式为H++OH-=H2O。
(2)当溶液中氢离子完全被消耗以后,继续加入氢氧化钠溶液沉淀镁离子和铝离子,则a点的沉淀有氢氧化镁和氢氧化铝。
(3)0-V1发生反应2NaOH+H2SO4=Na2SO4+2H2O。若当V1=140mL时,消耗氢氧化钠的物质的量是0.14mol,则剩余硫酸的物质的量是0.07mol,因此与金属反应的硫酸的物质的量是0.2mol-0.07mol=0.13mol。设镁和铝的物质的量分别是xmol、ymol,则x+y=0.1、x+1.5y=0.13,解得x=0.04、y=0.06,即金属粉末中n(Mg)=0.04mol。a点时形成硫酸钠溶液,根据原子守恒可知硫酸钠的物质的量是0.2mol,则氢氧化钠的物质的量是0.4mol,因此消耗氢氧化钠溶液的体积为400mL。生成氢氧化铝是0.06mol,根据Al(OH)3+NaOH=NaAlO2+2H2O可知消耗氢氧化钠是0.06mol,体积为60mL,所以V2=460mL。

 计算高手系列答案
计算高手系列答案【题目】一定温度下,向10 mL 0.40 mol/L H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++ O2↑+ 2H+,② H2O2 + 2Fe2+ + 2H+
2Fe2++ O2↑+ 2H+,② H2O2 + 2Fe2+ + 2H+ ![]() 2Fe3++2H2O,
2Fe3++2H2O,
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
反应过程中能量变化如下图所示。
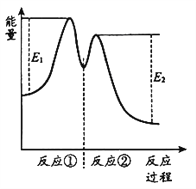
下列说法不正确的是
A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol/( L·min)
B. Fe3+的作用是增大过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq) ![]() 2H2O(l) + O2(g)的△H > 0
2H2O(l) + O2(g)的△H > 0