��Ŀ����
����Ŀ�����º����£���2 L�ܱ������м���MgSO4(s)��CO(g)��������Ӧ��MgSO4(s)��CO(g)![]() MgO(s)��CO2(g)��SO2(g)����Ӧ�����вⶨ�IJ������ݼ��±���
MgO(s)��CO2(g)��SO2(g)����Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | n(MgSO4)/mol | n(CO)/mol | n(SO2) / mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
����˵����ȷ����
A. 0��2 min�ڵ�ƽ������Ϊ�� (CO)��0.6 mol/(L��min)
B. 4 min��ƽ���ƶ���ԭ����������������м�����2.0 mol��SO2
C. �������¶ȣ���Ӧ��ƽ�ⳣ����Ϊ1.0��������ӦΪ���ȷ�Ӧ
D. �������������䣬��ʼʱ������MgSO4��CO��Ϊ1.0 mol����ƽ��ʱn(SO2)=0.6 mol
���𰸡�B
�����������������A���ɱ���ʱ���֪��0��2min��CO�����ʵ����仯��Ϊ2mol-0.8mol=1.2mol������(CO)��![]()
="0.3" molL-1min-1����A����B���ɱ������ݽ�Ϸ���ʽ��֪��0��2min��CO��CO2��SO2�����ʵ����仯��Ϊ2mol-0.8mol=1.2mol������2��4minʱ��ƽ��״̬��4��6minʱ��CO������0.4mol������ƽ���ƶ���ԭ��������������м�����2.0 mol��SO2����B��ȷ��C���ɱ���ʱ���֪��
MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g)
MgO(s)+CO2(g)+SO2(g)
��ʼ��mol���� 2 0 0
�仯��mol���� 1.2 1.2 1.2
ƽ�⣨mol���� 0.8 1.2 1.2
�ʸ��¶���ƽ�ⳣ��k=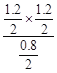 =0.9���������¶ȣ���Ӧ��ƽ�ⳣ����Ϊl.0����ƽ��������Ӧ�����ƶ�����������ӦΪ���ȷ�Ӧ����C����D����1L�ܱ������г���1.0mol MgSO4��1.0molCO����ԭƽ���ǵ�Чƽ�⣬n(CO2)=0.60mol�����������ݻ�����2Lʱ��ƽ�������ƶ����ʵ���ƽ��ʱn(CO2)��0.60mol����D����ѡB��
=0.9���������¶ȣ���Ӧ��ƽ�ⳣ����Ϊl.0����ƽ��������Ӧ�����ƶ�����������ӦΪ���ȷ�Ӧ����C����D����1L�ܱ������г���1.0mol MgSO4��1.0molCO����ԭƽ���ǵ�Чƽ�⣬n(CO2)=0.60mol�����������ݻ�����2Lʱ��ƽ�������ƶ����ʵ���ƽ��ʱn(CO2)��0.60mol����D����ѡB��

 �ο�������ϵ�д�
�ο�������ϵ�д� ������ѧ��ʱ��ҵϵ�д�
������ѧ��ʱ��ҵϵ�д� ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д� �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д�����Ŀ���������ʷ������ȷ����ǣ� ��
������� | ������ | ����� | ���������� | ���������� |
A. | Ư�� | ��ˮ | ������̼ | ������ |
B. | �ɱ� | ̼��� | һ������ | ���������� |
C. | CaCl2��8NH3 | ˮ | �������� | �������� |
D. | Һ�� | �Ȼ��� | �������� | ������ |
A.AB.BC.CD.D
����Ŀ��һ���¶��£���10 mL 0.40 mol/L H2O2��Һ�м�������FeCl3��Һ����ͬʱ�̲������O2�������������Ϊ��״�������±���ʾ��������ʾ����Ӧ���������У�
��2Fe3++ H2O2 ![]() 2Fe2++ O2��+ 2H+���� H2O2 + 2Fe2+ + 2H+
2Fe2++ O2��+ 2H+���� H2O2 + 2Fe2+ + 2H+ ![]() 2Fe3++2H2O��
2Fe3++2H2O��
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
��Ӧ�����������仯����ͼ��ʾ��

����˵������ȷ����
A. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2) = 3.33��10-2 mol/( L��min)
B. Fe3+�������������������ķֽ�����
C. ��Ӧ�������ȷ�Ӧ����Ӧ���Ƿ��ȷ�Ӧ
D. ��Ӧ2H2O2(aq) ![]() 2H2O(l) + O2(g)����H > 0
2H2O(l) + O2(g)����H > 0
