题目内容
11.N2H4是一种重要的火箭燃料,能在空气中燃烧生成氮气和水,放出大量的热.室温时,已知各共价键的键能如下表,通过计算N2H4的燃烧热是( )| 键 | N-H | N-N | O=O | N≡N | H-O |
| 键能/kJ•mol-1 | 391 | 193 | 497 | 946 | 463 |
| A. | 1088 kJ•mol-1 | B. | 544 kJ•mol-1 | C. | 790 kJ•mol-1 | D. | 382 kJ•mol-1 |
分析 先写出化学方程式N2H4+O2═N2+2H2O,然后根据焓变=反应物的总键能-生成物的总键能计算焓变,再根据化学方程式计算1mol肼完全燃烧时放出的热量;
解答 解:N2H4燃烧的化学方程式为N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=反应物的总键能-生成物的总键能=193kJ•mol-1+391 kJ•mol-1×4+497 kJ•mol-1-946 kJ•mol-1-463kJ•mol-1×4=-544 kJ•mol-1,N2H4燃烧的热化学方程式为N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-544 kJ•mol-1,所以N2H4的燃烧热是为577 kJ•mol-1,
故选:B;
点评 本题考查了化学反应的能量变化与反应的焓变关系,题目难度不大.注意反应热与键能以及化学计量数间的关系

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
1.在现代化学分析测试中,常借助一些仪器来分析化学物质的组成.下列有关说法不正确的是( )
| A. | 用红外光谱仪确定物质中是否存在Na+、K+、Cu2+等离子 | |
| B. | 用元素分析仪确定物质中是否含有C、H、O、N、S等 | |
| C. | 用原子吸收光谱确定物质中含有哪些金属元素 | |
| D. | 用pH计来测量溶液的酸碱性 |
6.一定条件下,在体积恒定的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g)△H<0.下列有关说法正确的是( )
| A. | 降低温度可以加快反应速率 | |
| B. | 达到化学反应限度时,生成2mol NH3 | |
| C. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 | |
| D. | 向容器中再加入N2可加快正反应速率 |
6.下列有关热化学方程式的叙述正确的是( )
| A. | 若C(s)+O2(g)=CO2(g)△H1,CO2(g)+C(s)=2CO(g)△H2,2CO(g)+O2(g)=2CO2(g)△H3,则反应热的关系:△H1=△H2+△H3 | |
| B. | 若2H2(g)+O2(g)=2H2O(1)△H4,H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H5,则反应热的关系:△H4=△H5 | |
| C. | 若2SO2(g)+O2(g)=2SO3(g)△H<O,则物质的稳定性:SO2>SO3 | |
| D. | 若断裂1molH2(g)中的H-H键、断裂1 molO2(g)中的共价键分别需要吸收436 kJ、498 kJ的能量,生成H2O(g)中的1 mol H-O键能放出463kJ的能量,则2H2(g)+O2(g)=2H2O(g)△H=-482kJ.mol-1 |
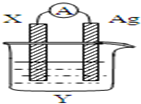 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到). AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)
AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变) 锌是一种较活泼的金属,具有广泛的用途.
锌是一种较活泼的金属,具有广泛的用途.