题目内容
【题目】一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃_____400℃(填“>”或“<”),该反应的ΔH____0(填“>”或“<”)。
②该反应自发进行的条件是__________(填高温、低温、任何温度)。
③对该反应,下列说法正确的是_________(填选项字母)。
A. 若容器内气体密度不变,则表明反应达到平衡状态
B. 若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C. 反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D. 反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
(2)工业上可利用反应2Cl2(g)+NH3(g)NHCl2(l)+2HCl(g)制备二氯胺。
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式______________________________。
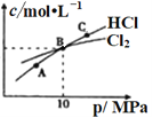
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是________点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)____α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=_____________。
【答案】> < 低温 AD NHCl2 +2H2O = 2HClO + NH3 C = 4
【解析】
(1)①根据温度对反应速率以及平衡移动的影响进行分析;
②ΔH-TΔS<0,反应能自发进行;
③A. NCl3(l)为液体,反应前后气体质量变化,气体体积不变,则气体的密度会随反应进行而变化;
B. 容器内Cl2和NH3物质的量之比为3:1,不能证明浓度不变;
C. 改变纯液体物质的用量,不影响平衡的移动;
D. 起始量为2molCl2和2molNH3,反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,相当于增大压强;
继续充入一定量反应物,相当于增大压强;
(2)①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质为次氯酸,另一物质为氨气;
②根据压强对平衡移动的影响比较转化率的大小;由于Cl2和NH3是按照化学计量数之比充入,则任一点均有,转化率:α(Cl2)=α(NH3);根据B点氯气和氯化氢物质的量相同,设参加反应氨气物质的量xmol,列三段式计算平衡时刻各气体物质的浓度,进而计算平衡常数。
(1)①温度越高,反应速率越快,其他条件相同时,由表格数据可知40min时,T℃时消耗氯气较多,且T℃时反应先达到平衡,则T℃时的反应速率比400℃时的反应速率快,则T℃>400℃;在400℃时,甲容器平衡后氯气为0.80mol,在T℃时,乙容器平衡后氯气为1.00mol,乙中剩余氯气较多,说明温度升高平衡逆向移动,则逆向为吸热反应,正向为放热反应,△H<0;故答案为:>;<;
②该反应正向为放热反应,且正向为熵减小的反应,ΔH-TΔS<0,反应能自发进行,则应为低温条件;故答案为:低温;
③A. NCl3(l)为液体,反应前后气体质量变化,气体体积不变,则气体的密度会随反应进行而变化,则若容器内气体密度不变,则表明反应达到平衡状态,故A正确;
B. 容器内Cl2和NH3物质的量之比为3:1,不能证明浓度不变,则不能表明反应达到平衡状态,故B错误;
C. NCl3为纯液体,改变其用量,不影响平衡的移动,故D错误;
D. 起始量为2molCl2和2molNH3,反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,相当于增大压强,平衡正向移动,达新平衡后Cl2的转化率增大,D项正确;故答案为:AD;
继续充入一定量反应物,相当于增大压强,平衡正向移动,达新平衡后Cl2的转化率增大,D项正确;故答案为:AD;
(2)①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质为次氯酸,该反应的化学方程式为NHCl2 +2H2O = 2HClO + NH3;故答案为:NHCl2 +2H2O = 2HClO + NH3;
②该反应2Cl2(g)+NH3(g)NHCl2(l)+2HCl(g)为气体体积减小的反应,增大压强平衡正向移动,氯气转化率增大,则A、B、C三点中氯气转化率最高的是C点;由于Cl2和NH3是按照化学计量数之比充入,则任一点均有,转化率:α(Cl2)=α(NH3);B点氯气和氯化氢物质的量相同,设参加反应氨气物质的量xmol,则可得三段式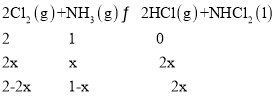 ,则2-2x=2x,解得x=0.5,则平衡是c(Cl2)=0.5mol/L,c(NH3)=0.25mol/L,c(HCl)=0.5mol/L,平衡常数
,则2-2x=2x,解得x=0.5,则平衡是c(Cl2)=0.5mol/L,c(NH3)=0.25mol/L,c(HCl)=0.5mol/L,平衡常数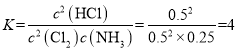 ;故答案为:C;=;4。
;故答案为:C;=;4。

 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】(1)已知①H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
②CH4 (g)+![]() O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
则CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:___。
(2)根据键能数据计算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热 ΔH=___kJ·mol-1。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(3)氢气是合成氨反应的重要原料。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟合成氨的工业化生产:N2(g)+3H2(g)![]() 2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。
2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。

回答下列问题:
①平衡时,M点NH3的体积分数为10%,则N2的物质的量为___(保留两位有效数字)。
②X轴上a点的数值比b点__(填“大”或“小”);图中,Y轴表示__(填“温度”或“压强”),判断的理由是__。
【题目】(1)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。反应能够自发进行,则反应的ΔH___0(填“>”“<”或“=”)。
2CO2+N2。反应能够自发进行,则反应的ΔH___0(填“>”“<”或“=”)。
(2)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
根据表中数据,计算反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的K。
CO(g)+H2O(g)的K。
①平衡常数的表达式K1=___;
②温度为973K时:K=___;(结果保留小数点后2位)
③反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
(3)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应___(填“已经”或“没有”)达到平衡,原因是__;此时刻v正__(填“>”或“<”)v逆。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应___(填“已经”或“没有”)达到平衡,原因是__;此时刻v正__(填“>”或“<”)v逆。