��Ŀ����
����Ŀ����������Ӱ�����ǵ��������β���ŷ������������������Ҫԭ��֮һ����֪����β���ŷ�ʱ���������·�Ӧ��
��N2(g)��O2(g)![]() 2NO(g) ��H1��akJ��mol��1
2NO(g) ��H1��akJ��mol��1
��2NO(g)��O2(g)![]() 2NO2(g) ��H2��bkJ��mol��1
2NO2(g) ��H2��bkJ��mol��1
��CO(g)��![]() O2(g)
O2(g)![]() CO2(g) ��H3��ckJ��mol��1
CO2(g) ��H3��ckJ��mol��1
��2CO(g)��2NO(g)![]() N2(g)��2CO2(g) ��H4
N2(g)��2CO2(g) ��H4
��ش��������⣺
��1�����ݷ�Ӧ�٢ڢۣ�ȷ����Ӧ������H4��____kJ��mol��1��
��2�������������ķ�Ӧ����ʾƽ�ⳣ��Kpʱ���������(B)��ƽ��ѹǿp(B)������������ʵ���Ũ��c(B)����Ӧ�ٵ�Kp��__(�ñ���ʽ��ʾ)��
��3�����������˵����Ӧ���Ѵ�ƽ��״̬����__(����ĸ)��
A.��λʱ��������1molNO2��ͬʱ������1molNO
B.�ں��º��ݵ������У����������ܶȱ��ֲ���
C.�ھ��Ⱥ��ݵ������У���Ӧ��ƽ�ⳣ�����ٱ仯
D.�ں��º�ѹ�������У�NO������������ֲ���
��4���Է��������²����ڷ�Ӧ���Է����е�ԭ��__��
��5��̽����Ӧ����ƽ��ʱCO2����������뷴Ӧ������ʼ![]() �ı�ֵ���¶ȵĹ�ϵ���õ���ͼ2��ʾ�����ߡ���X��Y��Z�����У�CO��ת���ʴӴ�С��˳����__��
�ı�ֵ���¶ȵĹ�ϵ���õ���ͼ2��ʾ�����ߡ���X��Y��Z�����У�CO��ת���ʴӴ�С��˳����__��

���𰸡�2c��a ![]() CD ��Ϊ�÷�Ӧ����H<0����S<0 Z>Y>X
CD ��Ϊ�÷�Ӧ����H<0����S<0 Z>Y>X
��������
��1�����ݸ�˹���ɼ����ʱ䣻
��2�����ݷ�Ӧ�ٵķ���ʽ�ó�Kp=![]() ��
��
��3����ѧ��Ӧ�ﵽ��ѧƽ��״̬ʱ�����淴Ӧ������ȣ��Ҳ�����0�������ʵ�Ũ�Ȳ��ٷ����仯���ɴ�������һЩ�������������仯���Դ˽����жϣ��ó���ȷ���ۣ�
��4�����ݸ÷�ӦΪ���������С�ķ��ȷ�Ӧ��ϡ�G=��H-T��S��0�Է��жϣ�
��5���¶�һ������CO����һ��ʱ������NO������ƽ�����ƣ�COת��������
��1�����ݸ�˹���ɣ���Ӧ����2-�ۼ��ã�ȷ����Ӧ��2CO(g)+2NO(g)N2(g)+2CO2(g)��H4=(2c-a)KJ/mol���ʴ�Ϊ��2c-a��
��2�����ݷ�Ӧ�ٵķ���ʽ�ó�Kp=![]() ��
��
��3��A����λʱ��������1mol NO2��ͬʱ������lmol NO����������Ӧ���ʲ���˵���ﵽƽ��״̬����A����
B��������һ�������һ�������ܶ�һ�����ʻ����������ʲ��ٷ����ı䲻��˵���ﵽƽ��״̬����B����
C���÷�Ӧƽ���ƶ�ʱ����������ı仯�����������ڵ��¶Ȼᷢ���仯���¶ȵı仯����ƽ�ⳣ���ı仯�����Ե�ƽ�ⳣ������ʱ˵����Ӧ�ﵽƽ��״̬����C��ȷ��
D���ں��º�ѹ�������У�NO������������ֲ��䣬��Ӧ��ƽ�⣬��˵���ﵽƽ��״̬����D��ȷ��
��ѡ��CD��
��4����Ϊ�÷�ӦΪ���������С�ķ��ȷ�Ӧ������H��0����S��0�������ڸ����¡�G=��H-T��S��0���Է����ʴ�Ϊ����Ϊ�÷�Ӧ����H<0����S<0��
��5���¶�һ������CO����һ��ʱ������NO������ƽ�����ƣ�COת��������![]() �ı�ֵԽ��CO��ת����Խ�ʴ�Ϊ��Z��Y��X��
�ı�ֵԽ��CO��ת����Խ�ʴ�Ϊ��Z��Y��X��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��һ�Ȱ������Ȱ������Ȱ�(NH2Cl��NHCl2��NCl3)�dz��õ�����ˮ������������
(1)��Cl2��NH3��Ӧ�Ʊ����Ȱ��ķ���ʽΪ3Cl2(g)+NH3(g)NCl3(l)+3HCl(g)�����ݻ���Ϊ1L�ļס�����������(��Ӧ�¶ȷֱ�Ϊ400�桢T��)�����зֱ����2molCl2��2molNH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
t /min | 0 | 40 | 80 | 120 | 160 |
��(400��)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
��(T��)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
��T��_____400��(����������������)���÷�Ӧ����H____0(����>������<��)��
�ڸ÷�Ӧ�Է����е�������__________(����¡����¡��κ��¶�)��
�۶Ը÷�Ӧ������˵����ȷ����_________(��ѡ����ĸ)��
A. �������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬
B. ��������Cl2��NH3���ʵ���֮��Ϊ3��1���������Ӧ�ﵽƽ��״̬
C. ��Ӧ��ƽ��������������䣬����һ������NCl3��ƽ�⽫���淴Ӧ�����ƶ�
D. ��Ӧ�ﵽƽ��������������䣬��ԭ�����а�![]() ��������һ������Ӧ�����ƽ���Cl2��ת��������
��������һ������Ӧ�����ƽ���Cl2��ת��������
(2)��ҵ�Ͽ����÷�Ӧ2Cl2(g)+NH3(g)NHCl2(l)+2HCl(g)�Ʊ����Ȱ���
��NHCl2�����ԡ����Ի����лᷢ��ǿ��ˮ�⣬���ɾ���ǿɱ�����õ����ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ______________________________��
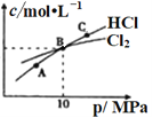
���ں��������£���2molCl2��1molNH3����ij�ܱ������з���������Ӧ�����ƽ��ʱCl2��HCl�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ����A��B��C������Cl2ת������ߵ���________��(����A����B������C��)��B��ʱ��Ӧ��ת���ʣ���(Cl2)____��(NH3)(����������=����������)����B��ƽ�����Ϊ2L����ƽ�ⳣ��K=_____________��